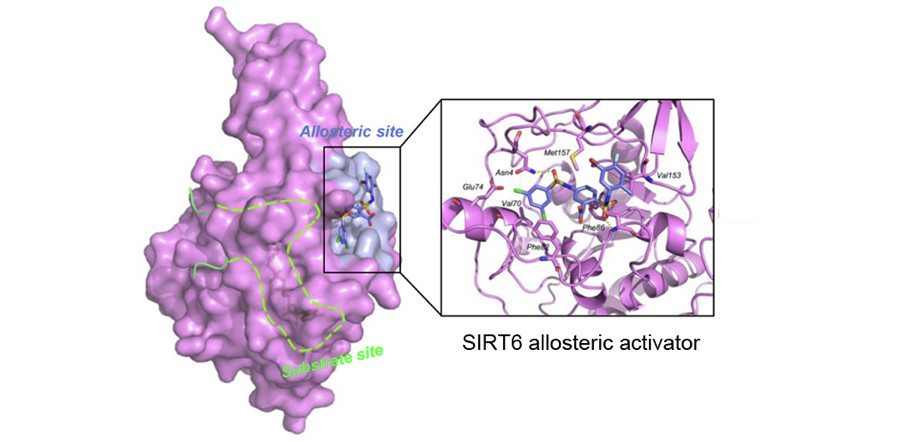
表观遗传调控是生命稳态维持的重要机制。其中,组蛋白乙酰化和机体生理功能及病理表征密切相关。作为组蛋白去乙酰化酶(Histone Deacetylases,HDACs)家族中的一个成员,SIRT6主要对组蛋白H3K9Ac和H3K56Ac进行去乙酰化,一直是人类衰老、代谢及肥胖、糖尿病、炎症、肿瘤等病理过程研究的明星分子。不同于大部分蛋白需要抑制剂,SIRT6作为组蛋白去乙酰化酶一直期待能有激动剂突破,为延缓衰老、治疗糖脂代谢类疾病及抗肿瘤研究提供新的路径。然而,目前尚未有可用于靶标功能研究和验证的SIRT6小分子激动剂报道。
最近一段时间,有关m6A修饰的相关研究可以说是当前整个生命科学领域最热门的方向之一,亮点文章频出,着实让人有些目不暇接。这些工作主要涉及m6A在果蝇性别决定、调节斑马鱼母源mRNA清除、小鼠精子发生、T细胞稳态调控以及抗病毒天然免疫中的重要作用。然而,对于m6A修饰在脊椎动物造血干细胞发育过程中的作用目前并没有相关报道,而且对整个造血干细胞发育过程的动态调控机制来说以现有的认识仍有待完善。9月6日,中科院北京动物所刘峰课题组与北京基因组研究所杨运桂课题组合作,在Nature杂志发表了题为“m6A modulates haematopoietic stem and progenitor cell specification”的论文,首次发现了m6A修饰对造血干细胞命运决定调控的重要作用,并揭示了相关调控在脊椎动物中的保守性,还将为体外诱导扩增造血干细胞提供了理论指导。该成果全部由我国科研人员在国内独立完成,是世界范围内造血干细胞领域的重要发现。有鉴于此,BioArt特别邀请到了四川大学生物治疗国家重点实验室长期从事血液干细胞研究的胡以国研究员对该工作进行点评,以飨读者
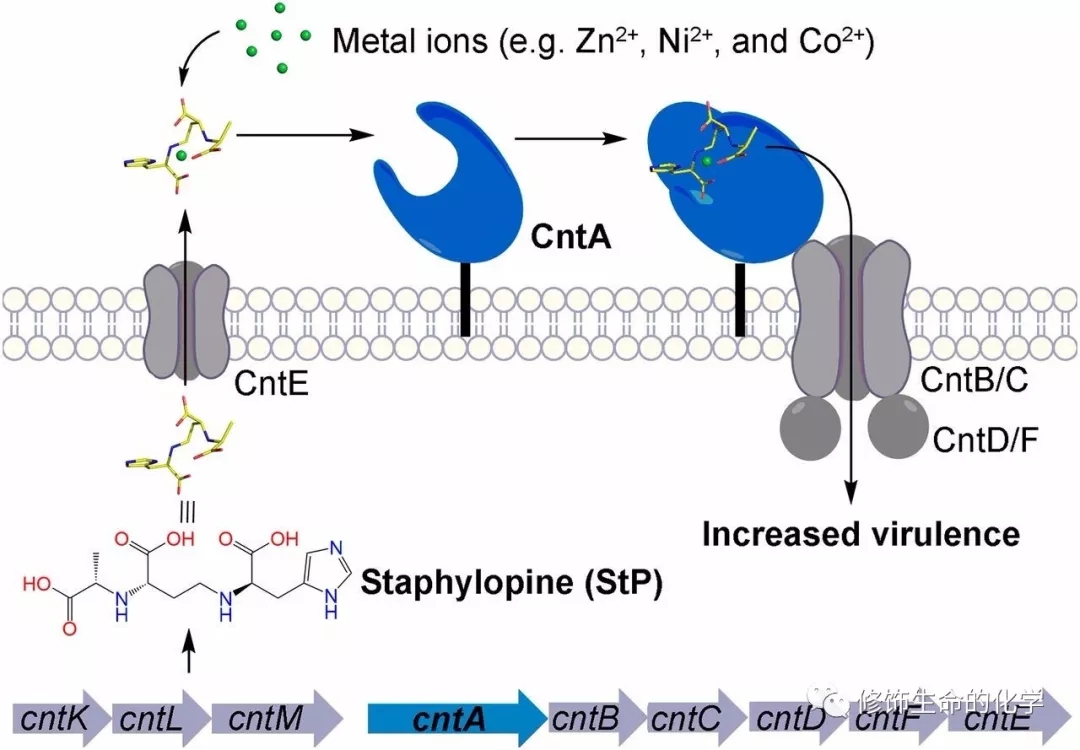
过渡金属离子是非常重要的营养物质,生物体内超过30%的蛋白含有过渡金属离子。其能够作为酶反应的催化中心,或者保持功能蛋白质的结构完整,以及作为信号分子行使功能[1]。金属离子的获取对病原细菌极为重要,是病原菌成功侵入宿主、繁殖自身、导致疾病的关键[2,3]。金黄色葡萄球菌(Staphylococcus aureus)是一种极具危害的革兰氏阳性菌,轻可引起轻微的皮肤化脓感染,重则导致危及生命的重大感染,如伪膜性肠炎、肺炎、全身化脓性感染等[4,5]。研究金黄色葡萄球菌如何侵入人类宿主并引发疾病的机制,对于预防感染和发展相应的治疗手段非常关键。2016年,Science曾报道了一种新的小分子金属螯合剂葡萄胺,由Cnt转运子上游的三个蛋白CntK/L/M合成[6]。进一步研究发现,它能够结合并调节Ni2+、Zn2+、 Co2+ 等过渡金属离子的转运,从而导致金黄色葡萄球菌的致病性。但葡萄胺/金属离子复合物的识别和转运的分子机制尚不清楚。
近几年来,围绕核酸的一系列新型修饰都是当前表观遗传方向最热门的研究领域之一,其中以研究RNA上的m6A修饰为最盛。就在5天前BioArt还报道了m6A修饰在调节T细胞稳态方面的重要作用(Nature:中美合作首次发现m6A修饰调控T细胞稳态)。尽管过去有研究暗示m6A修饰可能与雄小鼠育性相关联,然而有关研究却并没有很好的展开。那么m6A修饰是否与小鼠精子发生相关呢?8月15日,来自芝加哥大学何川与南京医科大学沈彬合作团队和中科院动物所周琪、李伟与中科院基因组所杨运桂合作团队在Cell Research杂志上“背靠背”发表了有关m6A修饰与精子发生的重要研究成果,首次通过基因敲除小鼠模型深入地研究了m6A甲基化酶以及识别蛋白在调控小鼠精子发生过程中的重要作用,清晰展示了m6A修饰新的重要功能。

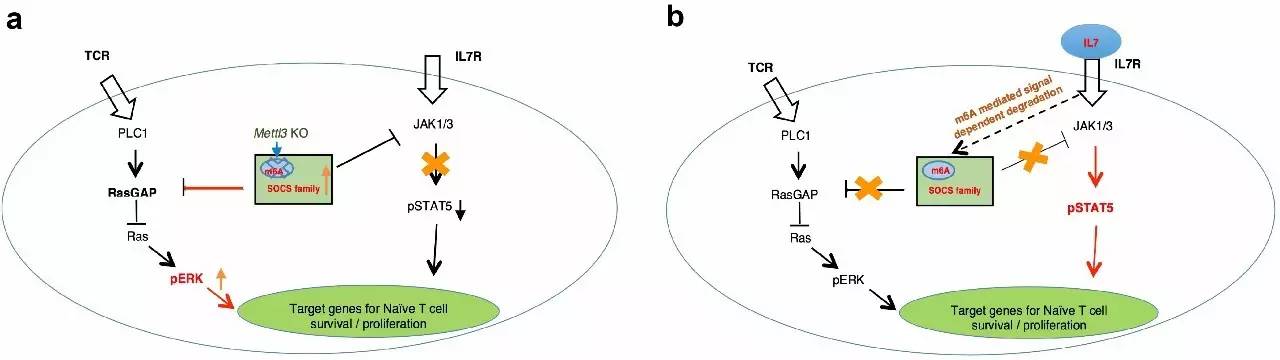
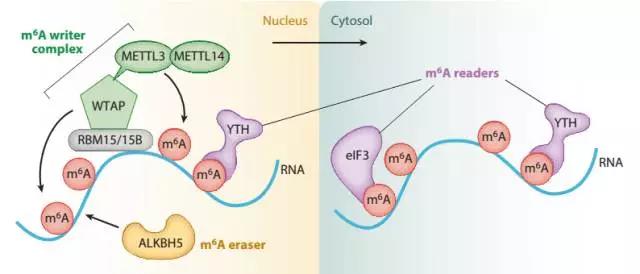
m6A (N6-methyladenosine,6-甲基腺苷酸)是真核生物mRNA中最常见的一种甲基化修饰,芝加哥大学何川教授首次证明m6A修饰可以被动态调控,暗示其可能具有重要的生理功能【1】。过去五年大量的实验表明,与DNA以及组蛋白的表观遗传修饰系统类似,m6A RNA表观遗传修饰系统也包括甲基转移酶(METTL3、METTL14等)、去甲基化酶(FTO、ALKBH5等)以及识别酶(YTHDC1、YTHDF2等)。此外,m6A修饰还参与调控mRNA代谢的全过程,特别是调控了mRNA的稳定性并且能够决定干细胞的分化【2-4】。Nature杂志最近半年还连续发文报道了m6A RNA修饰在斑马鱼和果蝇体内的功能【5-7】。辅助性T细胞是人体内重要的一类免疫细胞,在人体免疫监视和免疫防御过程中发挥重要作用。辅助性T细胞在不同的微环境作用下分化为不同的效应亚群,m6A是否参与调控辅助性T细胞的亚群分化和功能并不清楚。8月9日,Nature杂志在线发表了来自耶鲁大学Richard A. Flavell教授实验室和暨南大学尹芝南教授实验室合作的题为“m6A mRNA methylation controls T cell homeostasis by targeting IL-7/STAT5/SOCS pathway”的最新研究论文, 首次报道了m6A mRNA修饰在哺乳动物免疫细胞中的生理功能。该项研究发现,m6A通过靶向Naïve CD4 T细胞中IL-7/STAT5/SOCS信号通路中的信号分子mRNA来调控Naïve CD4 T细胞的分化,从而维持免疫系统的动态平衡。METTL3作为重要的甲基转移酶调控m6A RNA甲基化修饰,在CD4 T细胞中特异性敲除Mettl3基因,Naïve CD4 T细胞的分化受阻,从而抑制了T细胞过继转输诱导的肠炎模型中肠炎的发生。该项研究首次揭示了体内m6A甲基化修饰在T细胞介导的肠炎中的生理功能,为T细胞体内稳态和信号依赖的mRNA的降解提供了新的分子机制。鉴于该工作的重要意义,BioArt特别邀请了上海市免疫研究所的资深研究员李斌老师对该工作进行点评,以飨读者!
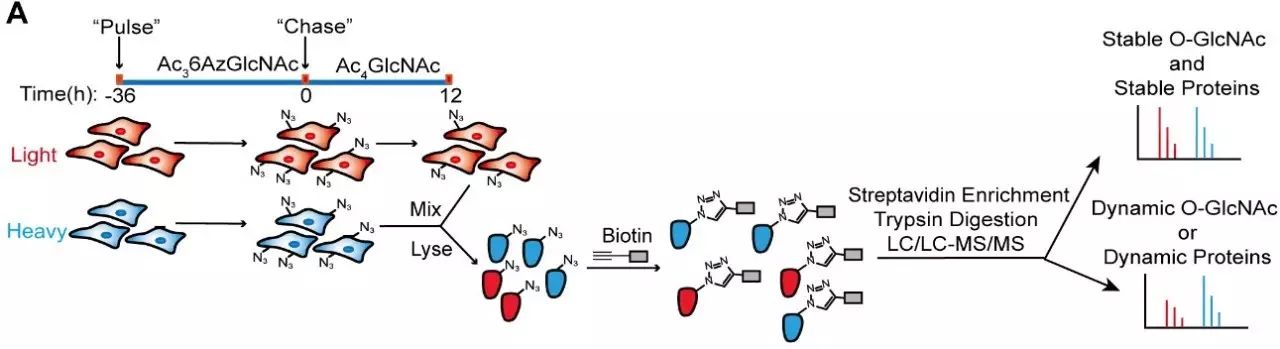
氧连接的β-N-乙酰葡萄糖胺修饰(O-GlcNAc)是哺乳动物细胞中一种广泛存在于蛋白质丝氨酸和苏氨酸上的动态、可逆的翻译后修饰,被其修饰的底物蛋白广泛地参与到细胞内各种信号传导通路中。尽管目前已经报道的O-GlcNAc修饰蛋白累积超过1000种,然而该修饰在细胞内的动态属性却没有被深入的分析和探究。7月31日,北京大学化学与分子工程学院、生命科学研究中心陈兴课题组与王初课题组合作在PNAS杂志上以长文形式(PNAS PLus)在线发表题为“Quantitative time-resolved chemoproteomics reveals stable O-GlcNAc regulates box C/D snoRNP biogenesis”的研究论文。该研究通过定量化学蛋白质组学与非天然糖代谢标记技术相结合,系统分析了O-GlcNAc修饰的动态属性,揭示了其与底物蛋白稳定性的关系,并对O-GlcNAc修饰调控box C/D snoRNP功能的作用机制进行了深入的探究。
