以下内容转自BioArt
最近一段时间,有关m6A修饰的相关研究可以说是当前整个生命科学领域最热门的方向之一,亮点文章频出,着实让人有些目不暇接。这些工作主要涉及m6A在果蝇性别决定、调节斑马鱼母源mRNA清除、小鼠精子发生、T细胞稳态调控以及抗病毒天然免疫中的重要作用。然而,对于m6A修饰在脊椎动物造血干细胞发育过程中的作用目前并没有相关报道,而且对整个造血干细胞发育过程的动态调控机制来说以现有的认识仍有待完善。9月6日,中科院北京动物所刘峰课题组与北京基因组研究所杨运桂课题组合作,在Nature杂志发表了题为“m6A modulates haematopoietic stem and progenitor cell specification”的论文,首次发现了m6A修饰对造血干细胞命运决定调控的重要作用,并揭示了相关调控在脊椎动物中的保守性,还将为体外诱导扩增造血干细胞提供了理论指导。该成果全部由我国科研人员在国内独立完成,是世界范围内造血干细胞领域的重要发现。有鉴于此,BioArt特别邀请到了四川大学生物治疗国家重点实验室长期从事血液干细胞研究的胡以国研究员对该工作进行点评,以飨读者。

论文解读:
众所周知,血液是生命的源泉。不断流动的血细胞既可以运输营养物质,又是重要的免疫保护屏障。其中,所有的血细胞都来源于造血干细胞。这群干细胞不仅可以维持血液系统的长期稳定,也是骨髓移植治疗恶性血液疾病的核心组分。目前,造血干细胞来源仍是制约临床恶性血液疾病治疗的瓶颈。因此,造血干细胞的体内发育和体外诱导扩增已成为当今科学界的热点课题之一。
在脊椎动物中,造血干细胞最初由特化的生血内皮通过内皮-造血转化(EHT)过程产生于胚胎期主动脉-性腺-中肾区,随后向胎肝(小鼠和人)或尾部造血组织(斑马鱼)迁移并进行扩增,向胸腺迁移以便发育为淋系细胞,最后,向骨髓(小鼠和人)或肾髓(斑马鱼)迁移以维持终生造血。经过几十年的研究与探索,我们对于造血干细胞的体内发育和体外诱导分化已有了基本的了解,但对整个过程的动态调控机制的认识仍不完善,尤其对于表观遗传修饰在脊椎动物造血干细胞发育过程中的作用更是知之甚少。
m6A(N6-甲基腺嘌呤)是最常见、最丰富的真核生物mRNA转录后修饰形式之一。该修饰过程是动态可逆的,并由甲基转移酶复合体(METTL3、WTAP和METTL14组成)、去甲基酶(FTO和ALKBH5)和相应的阅读器(YTHDF1/2/3,YTHDC1)协同调控。目前,m6A的生物学功能研究备受关注,并成为当前生命科学热门研究领域之一,近一段时间以来,Nature杂志连续发文报道了m6A在斑马鱼早期发育(Zhao et al., 2017)、果蝇性别决定(Lence et al., 2016)及T细胞稳态(Li et al., 2017)中的重要作用,此外最近还有关于m6A在抗病毒天然免疫(Zheng et al., 2017)和精子发生(Hsu et al., 2017;Xu et al., 2017)中的相关报道。尽管目前我们对于m6A修饰已经有了初步了解和认识,但是该修饰更广泛的生物学功能以及其作用机制仍有待深入探索和挖掘。
中科院动物研究所刘峰研究员领导的血液与心血管发育研究组长期以斑马鱼为模式生物研究造血干细胞发育的分子调控机制,不久前该课题组在Dev Cell杂志上还报道了血管微环境调控造血干细胞发育的新机制(详见此前BioArt的报道:Dev Cell:刘峰组发现血管微环境调控造血干细胞发育的新机制)。
刘峰课题组前期与北京基因组研究所杨运桂实验室合作发现并鉴定了斑马鱼中的m6A甲基转移酶复合体成分 (Ping et al., 2014)。在此基础上,研究人员通过m6A测序技术(m6A-Seq)发现,缺失m6A甲基转移酶mettl3后,m6A在胚胎发育相关mRNA中的富集程度显著下降。同时,在斑马鱼的血液-血管系统中,可检测到mettl3的特异性表达。由此推测,m6A修饰与血液发育过程密切相关。
进一步系统的表型检测显示,在mettl3缺失的胚胎中,造血干细胞不能正常产生,血管的内皮特性却明显增强,内皮-造血转化过程受到阻断。m6A-Seq和RNA-Seq综合分析发现,在mettl3缺失的胚胎中,一系列动脉内皮发育相关的基因,尤其是notch1a的m6A修饰水平显著降低,而其mRNA水平却显著升高。
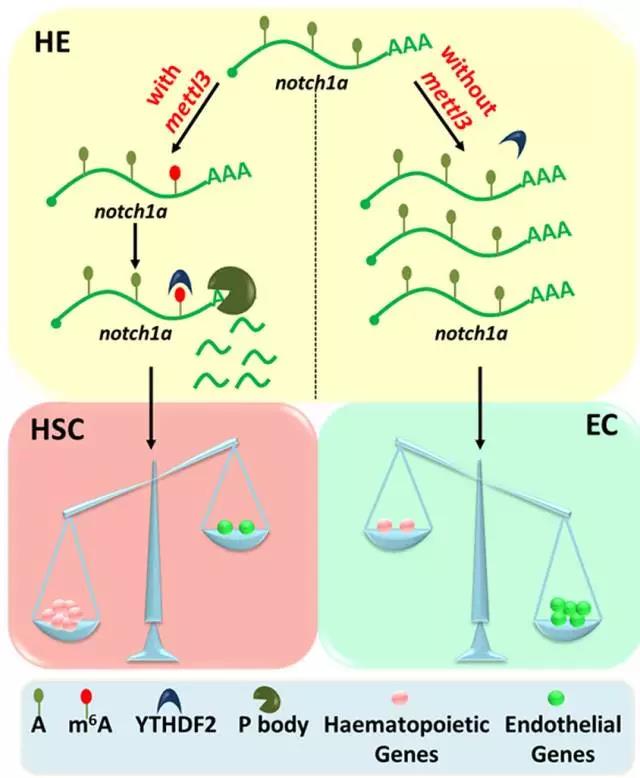
图:m6A修饰调控造血干细胞产生模式图。甲基转移酶Mettl3通过m6A修饰决定notch1a的mRNA水平,进而调控内皮-造血转化过程。
上述结果证明,m6A修饰与EHT过程中内皮和造血基因表达的平衡调控相关。此外,YTHDF2-RIP-Seq和单碱基分辨率的m6A-miCLIP-Seq发现,m6A通过YTHDF2介导notch1a mRNA的稳定性,以维持EHT过程中内皮细胞和造血细胞基因表达的平衡,进而调控造血干细胞的命运决定。上述结果在小鼠中也得到了验证,证明m6A对造血干细胞命运决定的调控在脊椎动物中是保守的。
该工作首次揭示m6A mRNA甲基化修饰在脊椎动物造血干细胞命运决定中的调控机制,丰富了对m6A mRNA甲基化在正常生理状态下的生物学功能的认识,是该研究领域的重大科研突破。上述成果不仅首次阐释RNA的表观修饰在血液发育中的关键作用,还将为体外诱导扩增造血干细胞提供了理论指导。
圆球代表干细胞,绿色部分代表内皮细胞,中间是RNA链,红色代表m6A修饰。
据悉,中国科学院动物研究所博士研究生张春霞、王璐副研究员,中国科学院基因组所博士生陈宇晟、孙宝发博士、杨莹博士为共同第一作者,刘峰研究员和中国科学院基因组所杨运桂研究员为共同通讯作者。该课题得到了国家杰出青年科学基金、国家自然科学基金重点项目、国家重点基础研究发展计划和中科院干细胞与再生医学战略性先导科技专项的资助。
专家点评:
胡以国 研究员(四川大学生物治疗国家重点实验室)
Comments:N6-甲基腺嘌呤(N6-methyladenosine, m6A)是高等生物mRNA中含量最多的在进化上保守的修饰之一。m6A 修饰是动态可逆的,修饰具有序列特异性、甲基化位点选择性。 m6A由甲基转移酶复合物WTAP/METTL3/METTL14催化形成及去甲基化酶ALKBH5和FTO催化去甲基化。目前发现,YTHDF1 (YTH domain-containing family protein 1)、YTHDF2 (YTH domain-containing family protein 2)、YTHDC1 (YTH domain-containing protein 1)和核内 HNRNPA2B1 (Heterogeneous nuclear ribonucleoproteins A2B1)识别并结合m6A。m6A修饰调控靶基因mRNA的稳定性及选择性剪切。mRNAm6A修饰在生命进程中的重要调控作用(张笑等,2016)。
最新发表在Nature杂志上的研究表明,m6A修饰调控靶基因mRNA在血管壁内皮细胞转化为造血干细胞的过程中起着及其重要的作用。这项研究由中国科学院动物研究所膜生物学国家重点实验室刘峰课题组和中国科学院北京基因组研究所杨运桂研究组联合完成,中国科学院动物研究所张春霞等为第一作者。
造血干细胞(haematopoietic stem cell HSC)是存在于造血组织中的一群原始造血细胞,成体中骨髓是干细胞的主要来源。前期的研究表明,HSC可以由血管内皮细胞转化而来。新近的结果显示,从成年小鼠器官中分离出血管内皮细胞,在体外将基因Fosb、Gfi1、Runx1、Spi1表达其中,可以将之转化为造血干细胞。同时用完全被辐射破坏体内血细胞生成和免疫系统缺陷的小鼠,将上述体外诱导扩增而来的造血干细胞移植至小鼠体内,小鼠的整个血液系统得以恢复,并发育出了免疫系统的所有正常组分(Lis et al., 2017)。
因此,全面理解血管内皮细胞转化成为HSCs的机制,使这种方法可以被规模化,并应用于人类,那么将具有十分广泛的临床意义。张春霞等的工作从mRNA修饰的角度进一步阐明m6A 修饰在此过程中的意义。他们的研究显示抑制参与m6A甲基转移酶复合物中的重要组成基因Mettl3, 对在转化过程中起重要作用的基因Runx1、 cMyb、Gata1、Pu.1和Rag1的mRNA量在血管内皮细胞显著降低,而在此过程中起抑制作用的Notch1a的mRNA量显著增高,结果抑制血管内皮细胞向HSCs转化。
参考文献
Lence, T., Akhtar, J., Bayer, M., Schmid, K., Spindler, L., Ho, C.H., Kreim, N., Andrade-Navarro, M.A., Poeck, B., Helm, M., et al. (2016). m6A modulates neuronal functions and sex determination in Drosophila. Nature 540, 242-247.
Li, H.B., Tong, J., Zhu, S., Batista, P.J., Duffy, E.E., Zhao, J., Bailis, W., Cao, G., Kroehling, L., Chen, Y., et al. (2017). m6A mRNA methylation controls T cell homeostasis by targeting the IL-7/STAT5/SOCS pathways. Nature 548, 338-342.
Ping, X.L., Sun, B.F., Wang, L., Xiao, W., Yang, X., Wang, W.J., Adhikari, S., Shi, Y., Lv, Y., Chen, Y.S., et al. (2014). Mammalian WTAP is a regulatory subunit of the RNA N6-methyladenosine methyltransferase. Cell research 24, 177-189.
Zhao, B.S., Wang, X., Beadell, A.V., Lu, Z., Shi, H., Kuuspalu, A., Ho, R.K., and He, C. (2017). m6A-dependent maternal mRNA clearance facilitates zebrafish maternal-to-zygotic transition. Nature 542, 475-478.
Zheng, Q., Hou, J., Zhou, Y., Li, Z., & Cao, X. (2017). The RNA helicase DDX46 inhibits innate immunity by entrapping m (6) A-demethylated antiviral transcripts in the nucleus. Nature immunology.
Xu, K., Yang, Y., Feng, G. H., Sun, B. F., Chen, J. Q., Li, Y. F., ... & Liu, C. (2017). Mettl3-mediated m (6) A regulates spermatogonial differentiation and meiosis initiation. Cell research.
Hsu, P. J., Zhu, Y., Ma, H., Guo, Y., Shi, X., Liu, Y., ... & Cheng, Y. (2017). Ythdc2 is an N (6)-methyladenosine binding protein that regulates mammalian spermatogenesis. Cell research.
张笑,贾桂芳,RNA 表观遗传修饰:N6 -甲基腺嘌呤.遗传Hereditas (Beijing) 2016 年 4 月,38(4): 275―288
Lis, R., Karrasch, C. C., Poulos, M. G., Kunar, B., Redmond, D., Duran, J. G. B., ... & Tabrizi, A. R. (2017). Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature, 545(7655), 439-445.

刘峰,博士,中国科学院动物研究所膜生物学国家重点实验室研究员,“国家杰出青年科学基金”获得者,科技部“中青年科技创新领军人才”。1999年毕业于中国科学院遗传研究所,获分子遗传学博士学位;2000年至2008年在新加坡分子农业生物学研究院、美国范德堡大学医学院和英国牛津大学分子医学研究所利用斑马鱼和非洲爪蟾从事造血干细胞的基础研究。2009年回国后,刘峰博士带领的血液与心血管发育研究组以斑马鱼和小鼠为模型,研究血液系统发育的分子机制,重点关注血液与心血管干细胞/前体细胞的形成、造血干细胞命运决定、维持及分化等。近年来,以通讯作者在Nature、Dev Cell、PNAS、JEM、Blood、Nat Commun、Cell Res、Development等杂志发表论文20余篇。课题组承担了科技部、国家自然科学基金委以及中国科学院等一系列重大课题。与此同时,刘峰博士还担任国际斑马鱼学会执行委员、中国动物学会斑马鱼分会主任委员以及中国动物学会发育生物学专业委员会副主任委员兼任秘书长等。

杨运桂,博士,现任中国科学院北京基因组研究所研究员,国家“杰青”。杨运桂研究员1995年本科毕业于复旦大学生命科学学院,2000年博士毕业于中科院上海药物所/上海生物工程研究中心(导师杨胜利教授/中国工程院院士),分别在法国世界卫生组织国际癌症研究中心(2000-2005年)(导师汪兆琦教授/欧洲科学院院士)和英国癌症研究所Clare Hall实验室(2005-2008年)(导师Tomas Lindahl教授/英国皇家科学院院士/2015年诺贝尔化学奖得主)接受博士后科研训练。2008年获聘中国科学院北京基因组研究所,2014年任中国科学院大学生命科学科教融合卓越创新中心教授,2014年任中国科学院精准基因组医学重点实验室副主任,2015年任中国科学院北京基因组研究所学术委员会主任。杨运桂研究员致力于探讨RNA表观转录组调控与作用机理,鉴定RNA甲基化修饰(如6-甲基腺嘌呤-m6A)编码器、读码器及解码器重要蛋白,阐明其调控机制和生物学功能及与人类疾病关联。参与发现RNA 6-甲基腺嘌呤修饰甲基转移酶和去甲基化酶,证实了RNA甲基化修饰类似于DNA甲基化,具有可逆性及调控mRNA加工代谢的生物学功能,为中心法则增加了除表观基因组和表观蛋白组之外的一种新的表观转录组(RNA甲基化)调控层次。近年来,杨运桂研究员的成果主要发表在Nature、Cell Stem Cell、Molecular Cell、Nature Communications、Cell Research等杂志上。
