以下内容转自BioArt
氧连接的β-N-乙酰葡萄糖胺修饰(O-GlcNAc)是哺乳动物细胞中一种广泛存在于蛋白质丝氨酸和苏氨酸上的动态、可逆的翻译后修饰,被其修饰的底物蛋白广泛地参与到细胞内各种信号传导通路中。尽管目前已经报道的O-GlcNAc修饰蛋白累积超过1000种,然而该修饰在细胞内的动态属性却没有被深入的分析和探究。7月31日,北京大学化学与分子工程学院、生命科学研究中心陈兴课题组与王初课题组合作在PNAS杂志上以长文形式(PNAS PLus)在线发表题为“Quantitative time-resolved chemoproteomics reveals stable O-GlcNAc regulates box C/D snoRNP biogenesis”的研究论文。该研究通过定量化学蛋白质组学与非天然糖代谢标记技术相结合,系统分析了O-GlcNAc修饰的动态属性,揭示了其与底物蛋白稳定性的关系,并对O-GlcNAc修饰调控box C/D snoRNP功能的作用机制进行了深入的探究。

论文解读:
哺乳动物细胞内蛋白质的丝氨酸和苏氨酸残基上存在一种重要的单糖基化修饰--氧连接氮乙酰葡萄糖胺(O-GlcNAc)修饰,其修饰水平由O-GlcNAc转移酶(OGT)和O-GlcNAc水解酶(OGA)精密调控,被其修饰的底物蛋白广泛地参与到细胞内各种信号传导通路中【1】。在蛋白层面上,O-GlcNAc被报道可以调控蛋白的稳定性【2】和活性【3】。迄今为止,已经报道的O-GlcNAc修饰蛋白累积超过1000种,然而该修饰在细胞内的动态属性却没有被深入的分析和探究【4】。是否所有蛋白上的O-GlcNAc修饰都非常动态?或者不同蛋白上的O-GlcNAc修饰的动态速率是否不一样?以及O-GlcNAc对不同底物蛋白的稳定性是否有不同的调节?
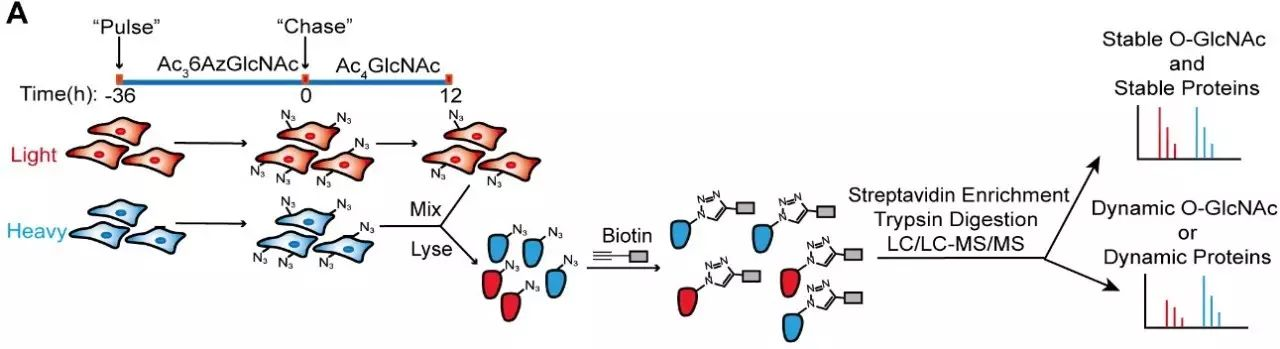
工作流程示意图
为了测定O-GlcNAc修饰蛋白的动态变化,陈兴和王初课题组基于细胞培养稳定同位素标记法(SILAC)的定量蛋白质组学技术【5】和非天然糖代谢标记技术【6】,合作开发了一种高效的、具有时间分辨力的O-GlcNAc定量化学蛋白质组学分析技术(qTOP)。利用该方法,其研究团队首先定量鉴定了七百多个高置信度的O-GlcNAc修饰蛋白。在此基础之上,他们对其中五百多个O-GlcNAc修饰蛋白的动态变化速率进行精准地定量分析,并根据修饰变化速率的快慢对底物蛋白进行了归类。在此过程中,研究人员发现了数十种O-GlcNAc修饰异常稳定的蛋白,这些蛋白在通过抑制OGT降低O-GlcNAc水平后,其蛋白丰度也发生了明显的下调,暗示O-GlcNAc修饰与调控底物蛋白稳定性有着密切的关联。
为了进一步验证O-GlcNAc修饰对底物蛋白稳定性的影响,作者对其中三个带有稳定O-GlcNAc修饰的底物蛋白(FBL, NOP58和NOP56)做了详细的功能验证。这三个蛋白是box C/D snoRNP复合物的重要组成部分。该复合物负责对核糖体RNA进行2’-O-甲基化修饰,对核糖体生成和翻译起着非常重要的作用,在很多癌细胞中该复合物都处于高表达状态并促进肿瘤的生长【7】。通过OGT的小分子抑制剂和siRNA降低细胞内的O-GlcNAc修饰水平,作者发现box C/D snoRNP各个组分的降解速率显著加快。对于在该复合物中执行甲基转移酶功能的FBL蛋白,作者成功地鉴定到其142位丝氨酸为O-GlcNAc修饰位点,突变该糖基化位点能够显著提高了FBL的降解速率,并且干扰了其在核仁中的定位以及与其它三个组成蛋白的相互作用。而box C/D snoRNP稳定性的下降进一步降低了下游核糖体RNA的2’-O-甲基化修饰水平,并且显著减缓了肿瘤的生长速率。
综上所述,该工作通过定量化学蛋白质组学与非天然糖代谢标记技术相结合,系统分析了O-GlcNAc修饰的动态属性,揭示了其与底物蛋白稳定性的关系,并对O-GlcNAc修饰调控box C/D snoRNP功能的作用机制进行了深入的探究。
据悉,陈兴教授与王初特聘研究员为本文共同通讯作者。本文第一作者是他们共同指导的生命科学联合中心三年级博士研究生秦为。陈兴课题组研究生吕品欧、范欣琦、朱蕴韬、覃珂和王初课题组研究生陈影,本科生全柏峄对本工作做出了贡献。该研究工作得到了国家自然科学基金委、科技部、和北大-清华生命科学联合中心的资助。
参考文献:
1. Hart GW (2014) Minireview Series on the Thirtieth Anniversary of Research on O-GlcNAcylation of Nuclear and Cytoplasmic Proteins: Nutrient Regulation of Cellular Metabolism and Physiology by O-GlcNAcylation. J Biol Chem289(50):34422-34423.
2. Ruan HB, Nie YZ, & Yang XY (2013) Regulation of Protein Degradation by O-GlcNAcylation: Crosstalk with Ubiquitination. Mol Cell Proteomics 12(12):3489-3497.
3. Yi W, et al. (2012) Phosphofructokinase 1 glycosylation regulates cell growth and metabolism. Science (New York, N.Y.) 337(6097):975-980.
4. Woo CM, Iavarone AT, Spiciarich DR, Palaniappan KK, & Bertozzi CR (2015) Isotope-targeted glycoproteomics (IsoTaG): a mass-independent platform for intact N- and O-glycopeptide discovery and analysis. Nat Methods 12(6):561-+.
5. Ong SE, et al. (2002) Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol Cell Proteomics 1(5):376-386.
6. Cecioni S & Vocadlo DJ (2013) Tools for probing and perturbing O-GlcNAc in cells and in vivo. Current opinion in chemical biology 17(5):719-728.
7. Marcel V, et al. (2013) p53 acts as a safeguard of translational control by regulating fibrillarin and rRNA methylation in cancer. Cancer cell 24(3):318-330.
通讯作者简介:
陈兴,北京大学化学与分子工程学院教授。2002年本科毕业于清华大学化学系,2007年获加州大学伯克利分校化学博士,随后在哈佛大学医学院从事博士后研究。2010年起,任北大化学学院研究员,合成与功能生物分子中心PI,生命科学联合中心PI。2016年晋升为北京大学长聘正教授。2014年获国家杰出青年科学基金。所获奖项包括:美国化学会David Gin New Investigator Award (2016), CAPA Biomatik Distinguished Faculty Award(2015)、IGO Young Glycoscientist Award(2015)、药明康德生命化学奖(2015)、 中国化学会青年化学奖(2013);美国DuPont Young Professor Award(2013)、SCOPUS青年科学之星金奖(2013)。目前研究兴趣主要为化学糖生物学。

陈兴教授课题组合影
王初研究员2001年本科毕业于中国科学技术大学生物学系,2007年在美国University of Washington生物化学系获博士学位,研究方向为计算生物学。2009-2013年在美国The Scripps Research Institute做博士后,研究方向为化学生物学。于2013年12月在北京大学化学与分子工程学院化学生物系开始独立研究工作,并入选北大合成与功能生物分子中心和北大-清华生命联合中心,任PI。其课题组主要研究方向为(1)运用化学蛋白质组学和化学生物学技术发掘氧化应激条件下,细胞内发生共价修饰的氨基酸功能位点(2)利用组学技术分析和鉴定天然产物生物活性成分在细胞内的分子靶标及作用位点。(3)研发计算生物学方法,对小分子配体对蛋白质共价修饰进行结构模拟预测和分子设计。

王初研究员课题组合影
