前列腺癌(PC)是目前全球男性中最常见的肿瘤之一。尽管在过去几十年中,前列腺癌患者的生存率已有很大的提高,但转移性去势抵抗性前列腺癌(mCRPC)仍然是一种致命性疾病。基因组测序表明,大约90%的mCRPC患者携带具有临床靶向潜力的基因异常,其中涉及DNA损伤修复相关基因的突变是最常见的遗传改变之一。具体而言,大约25%的mCRPC患者携带同源重组(HR)修复所需基因(如BRCA1/2、ATM、ATR 和 PALB2)功能缺失性突变。基于“合成致死”理论,HR修复缺陷会使细胞对PARP抑制剂(PARPi)高度敏感。目前,美国FDA已批准PARPi用于治疗携带BRCA1/2功能缺失突变的mCRPC患者。然而,仍有相当一部分具有HR缺陷的mCRPC患者对PARPi治疗没有反应。因此,鉴定能够预测PARPi治疗敏感性的生物标志物,以实现更精准的个体化治疗,仍然是当前临床面临的一大挑战。
此外,临床发现尽管患者最初对PARPi显示良好的治疗效果,但大多数患者在接受PARPi治疗后不可避免地出现耐药情况。截至目前,针对其他肿瘤,多种PARPi耐药机制已被发现,包括BRCA1/2功能回复突变、PARP1表达下调、以及DNA复制叉稳定性提升等。基于这些发现,研究者已提出多种联合治疗策略,以增强PARPi的敏感性以缓解耐药。然而,在mCRPC中, PARPi的耐药机制及治疗策略仍未被完全阐明。
2025年6月26日,美国梅奥医学中心(Mayo Clinic)楼振昆 (Zhenkun Lou)教授课题组联合汪列维(Liewei Wang)教授课题组在Molecular Cell杂志在线发表题为:Isoform-Specific Function of NSD3 in DNA Replication Stress Confers Resistance to PARP Inhibitors in Prostate Cancer的研究论文。在该研究中,作者发现E3泛素酶CUL3ZBTB2介导的NSD3S表达异常是PC细胞对PARPi产生耐药的主要原因。利用PC耐药细胞、mCRPC患者来源的类器官及PDX小鼠模型,作者提出NSD3S是一个预测mCRPC中PARPi敏感性的生物标志物,并且验证了NSD3 PROTAC降解剂在干预PARPi耐药中的效果。
NSD3是一个组蛋白赖氨酸甲基转移酶,负责催化H3K36位点的甲基化(H3K36me2/3)。在细胞中,NSD3存在两种主要的剪接体,其中长的剪接体(NSD3L)包含所有的结构域并具有甲基化修饰功能,而短的剪接体(NSD3S)因其C端缺少SET结构域而没有组蛋白修饰功能。通过特异性的敲低NSD3L及NSD3S,作者首先发现NSD3S,而非NSD3L,在细胞DNA损伤应答反应中扮演重要的角色。随后作者发现,NSD3S在PARPi耐药的PC细胞中高表达,而NSD3L的表达却没有明显的变化。体内、体外实验表明,敲低NSD3S或者使用NSD3 PROTAC降解剂可以有效的逆转PARPi耐药、增强PARPi敏感性。进一步的,在NSD3ShiBRCA2功能缺失突变的mCRPC PDX模型中,作者发现NSD3 PROTAC降解剂可以有效增强PARPi的敏感性。
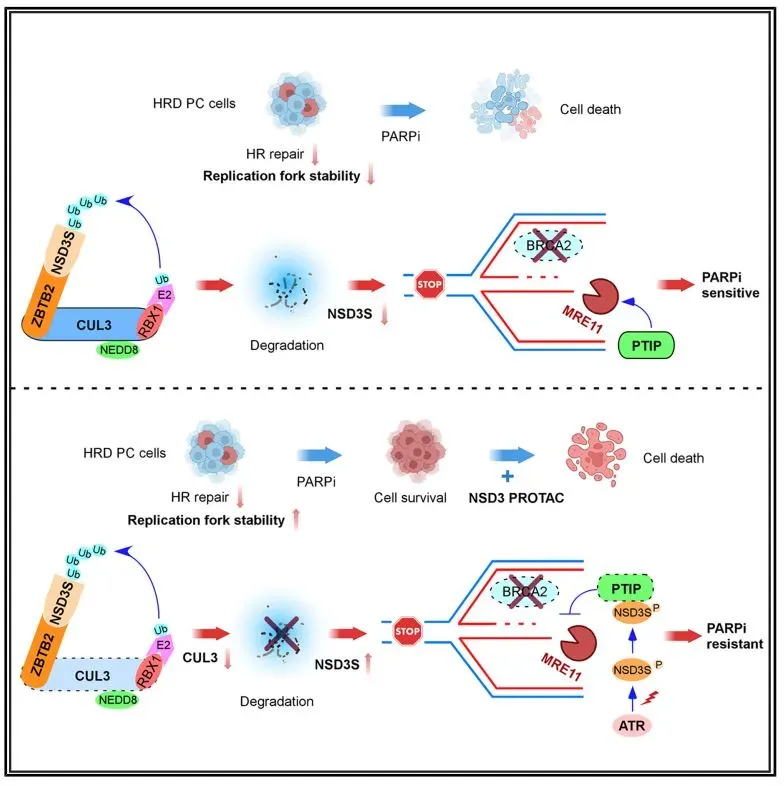
随后,作者探究了PARPi耐药细胞中NSD3S异常高表达的原因。通过质谱实验,作者发现E3泛素连接酶CUL3ZBTB2可以特异性的催化NSD3S发生泛素化修饰进而导致其降解。作者随后证实,PARPi耐药细胞中CUL3的表达降低是导致NSD3S表达升高的主要原因。
机制研究表明,在DNA复制应激条件下NSD3S可以被ATR激酶磷酸化。PTIP通过其BRCT结构域识别磷酸化的NSD3S,进而招募NSD3S至停滞的复制叉。由于NSD3S与MRE11识别PTIP蛋白中一段相同的区域,NSD3S竞争性的抑制核酸酶MRE11在停滞复制叉上的募集,从而减弱了MRE11对复制叉的降解,增强了停滞复制叉的稳定性,导致细胞对PARPi的不敏感性。
总之,在本研究中作者发现NSD3S可以通过抑制MRE11增强停滞复制叉的稳定性降低前列腺癌细胞对PARPi的敏感性,导致耐药性的产生。NSD3S的表达可以作为预测前列腺癌中PARPi敏感性的一个指标。同时,作者通过体内、体外实验证实使用PROTAC靶向降解NSD3可以作为一种提高PARPi治疗效果的干预策略。此外,本研究揭示的CUL3ZBTB2对NSD3不同剪接体的特异性催化功能也印证了一种底物介导的E3连接酶CUL3蛋白Neddylation修饰调控机制。
原文链接:https://doi.org/10.1016/j.molcel.2025.06.004
