热量限制(Caloric Restriction, CR)作为一种经典的饮食干预模式,其核心是在避免营养不良的前提下,适度减少每日的热量摄入。CR不仅能有效降低肿瘤发生率,还可以抑制肿瘤进展、增强治疗效果。然而,CR对饮食控制要求较高,肿瘤患者往往难以长期坚持,从而限制了其临床转化与应用。
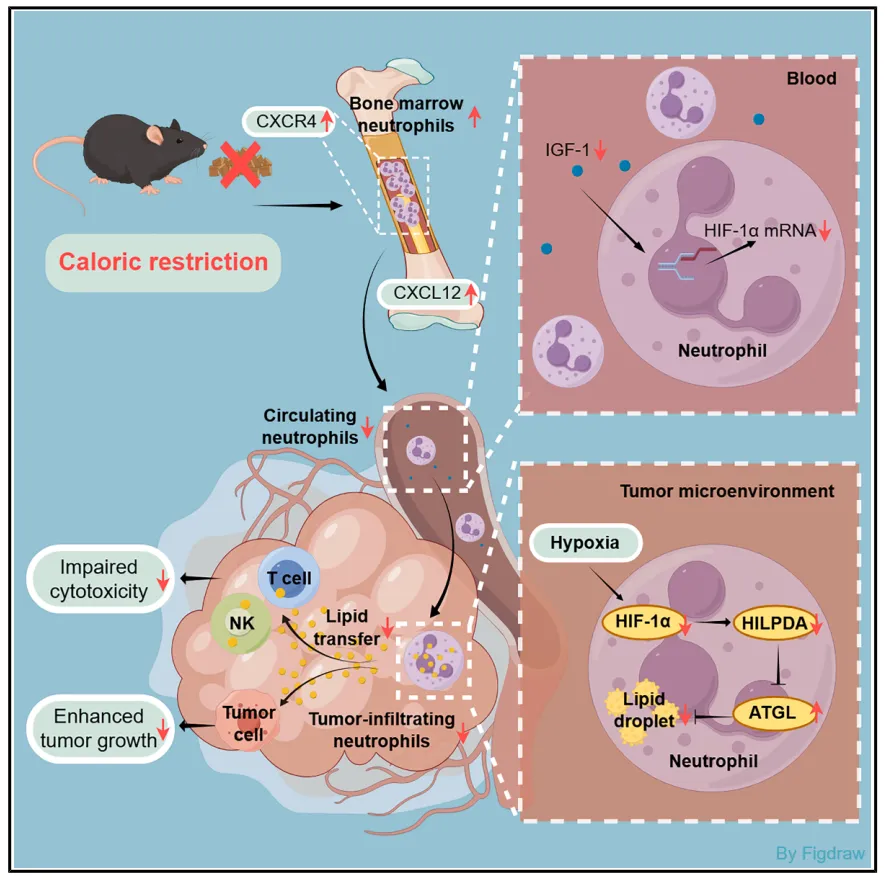
2025年12月5日,上海交通大学甘愉、屠红、李佩盈共同通讯在Cell Metabolism(IF=30.9) 在线发表题为“Restricting lipid accumulation in tumor-infiltrating neutrophils mediates caloric restriction-induced anti-cancer effects”的研究论文,该研究发现限制肿瘤浸润中性粒细胞中的脂质积累调控热量限制诱导的抗癌作用。在这里,研究人员表明发现CR改变了肿瘤浸润性中性粒细胞(TINs)的比例和基因表达谱。中性粒细胞的减少在很大程度上消除了CR诱导的多种小鼠癌症模型的肿瘤抑制作用,强调了它们在CR的广泛抗肿瘤作用中的关键作用。CR诱导的TINs基因表达变化主要与脂质相关过程相关,特别是下调低氧诱导的脂滴相关(HILPDA)。这种下调减少了TINs中的脂质积累,通过减少脂质转移到肿瘤和免疫效应细胞来限制肿瘤生长和增强抗肿瘤免疫。在上游,CR通过减少胰岛素样生长因子1 (IGF-1)减少循环中性粒细胞中缺氧诱导因子1 (HIF-1α) mRNA的表达,从而限制TINs中HILPDA的表达。中性粒细胞HIF-1α mRNA基线水平较低的肺癌患者对联合免疫疗法的反应有所改善。这些发现确定了一种新的以中性粒细胞和脂质为中心的CR诱导肿瘤抑制机制,提示IGF-1/HIF-1α/HILPDA轴是一个治疗靶点。
癌症与整体代谢状况密切相关。膳食热量摄入是影响整体代谢的重要生活方式因素,因此对癌症有显著影响。流行病学观察结果支持这一观点,即低热量摄入与乳腺癌风险降低相关。热量限制(CR)涉及在不导致营养不良的情况下将热量摄入减少10%-50%,在实验动物中显示出很强的抗癌活性。与喂食的恒河猴相比,食用30%铬饮食的动物的自发性癌症发病率降低了40%-50%。在啮齿类动物中,CR或禁食(CR的可行替代方案)不仅可以减少肿瘤的发展,还可以抑制各种癌症模型(如乳腺癌、结肠癌和黑色素瘤)中的肿瘤生长或转移。
最近,一项涉及三阴性乳腺癌患者的临床试验显示,模拟禁食的饮食增加了化疗的疗效,表明了CR相关饮食干预的临床意义。然而,由于其严格性和长期可持续性的挑战,直接应用CR或禁食受到限制。因此,对潜在机制的深入探索可能为可行和有效的癌症治疗策略提供新的机会。一些在癌症中起作用的代谢途径,如胰岛素样生长因子1 (IGF-1)信号,受CR调节。然而,CR诱导的抗肿瘤表型的机制尚未完全了解。
机理模式图(图源自Cell Metabolism )
饮食热量摄入与免疫功能调节有关。饮食诱导的肥胖与慢性炎症和针对各种感染的免疫应答中断有关。相比之下,CR可降低全身炎症,并导致循环白细胞的重新分布到骨髓而不增加增加感染的易感性。最近的一项研究表明,CR诱导的BM中记忆T细胞的积累增强了对继发性细菌感染的免疫保护。在癌症的情况下,CR模拟物或禁食被发现可促进T细胞介导的抗肿瘤活性,并损害调节性T细胞。此外,CR改变了自然杀伤(NK)细胞的终末成熟,刺激后细胞因子产生和细胞毒性增加,从而增强了NK细胞的免疫监控。尽管已有关于CR对T细胞和NK细胞免疫调节作用的研究,但其他免疫细胞如中性粒细胞在CR诱导的肿瘤抑制中的作用仍知之甚少。
在这项研究中,研究人员揭示了CR对肿瘤浸润性中性粒细胞(TINs)的深远影响,并证明了中性粒细胞在CR诱导的各种癌症模型的肿瘤抑制中的关键作用。基于这些发现,发现了一种新的blood-to-TIN IGF-1/缺氧诱导因子1(HIF-1)α/缺氧诱导脂滴相关(HILPDA)轴,CR通过该轴抑制肿瘤生长并增强抗程序性死亡受体1 (PD-1)的疗效。总之,该研究揭示了一种新的血液转化为TIN的机制,CR通过这种机制削弱了TIN的促瘤和免疫抑制活性。该发现促进了对CR的抗癌机制的理解,并指出IGF-1/ HIF-1α/HILPDA轴介导的TIN中的脂质积聚是一个有希望的癌症治疗靶点。
原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00491-7
