AKT通路的异常激活是肝细胞癌(HCC)发生的关键驱动因素。由于AKT能够激活多条下游信号通路,必须阐明介导AKT驱动肿瘤发生的关键机制,以制定最佳治疗策略。
2025年11月24日,重庆医科大学赵金秋和夏威夷大学陈昕,Xue Wang共同通讯在Cancer Research(IF=12.5)在线发表题为“Inhibition of GSK3 and TSC2 Mediates the Oncogenic Activity of AKT in Hepatocellular Carcinoma”的研究论文。该研究发现AKT通过靶向结节性硬化复合物2(TSC2)和糖原合成酶激酶3α/β(GSK3α/β)而非叉头框O蛋白家族成员来促进肿瘤发生。
在体内实验中,TSC2缺失(导致mTORC1激活)或两种GSK3亚型的同时缺失均可与激活的NRAS协同促进HCC形成,但潜伏期存在差异。同时缺失TSC2与GSK3α/β可与NRAS协同快速诱导HCC形成,这一现象与Akt/NRas HCC模型中的观察结果一致。RNA测序研究表明,在肝癌发生过程中TSC2/mTORC1与GSK3α/β分别调控不同的信号通路,其中FOXM1作为GSK3的主要效应分子发挥作用。总之,这些发现揭示了AKT通过抑制TSC复合物与GSK3驱动HCC发展的作用机制,为致癌信号传导研究和潜在治疗靶点开发提供了理论依据。
肝细胞癌(HCC)是最常见的原发性肝癌类型,也是全球癌症相关死亡的第三大原因。美国食品药品监督管理局已批准多种用于晚期HCC的治疗方案,包括酪氨酸激酶抑制剂(如索拉非尼和仑伐替尼),以及免疫治疗联合抗血管生成治疗(即阿特珠单抗与贝伐珠单抗组合)。然而,提高HCC患者总生存率并降低复发率仍面临挑战。因此,亟需探索针对该侵袭性肿瘤的新型潜在有效治疗靶点。
PI3K/AKT信号通路在HCC发生发展中起关键作用。研究报道人类HCC中存在多种导致AKT激活的遗传学事件。例如,PIK3CA的激活突变可调控涉及增殖、存活、迁移、代谢、分化和葡萄糖稳态等多种细胞过程的基因。在该通路中,T308和S473位点的磷酸化可激活AKT丝氨酸/苏氨酸激酶。AKT激活后通过磷酸化作用抑制若干经典下游靶点,如叉头框O蛋白(Foxo)、结节性硬化复合物2(TSC2)和糖原合成酶激酶3(GSK3)。这些AKT靶点也被证实参与HCC的发生与进展。
Foxo家族成员(特别是Foxo1)被认为是AKT在肝脏中的主要作用靶点。事实上,Foxo1缺失可逆转Akt1/2缺失诱导的胰岛素抵抗、肝再生障碍及肝脏肿瘤发生。然而,Foxo(特别是Foxo1)在介导AKT致癌潜能中的具体作用尚不明确。
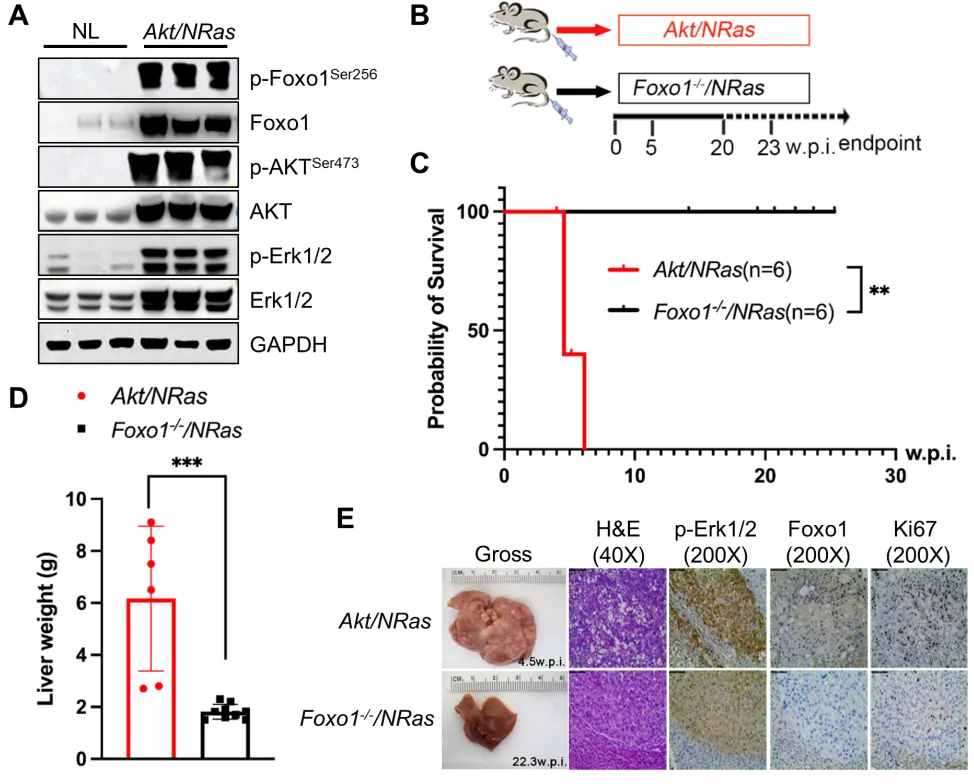
在AKT / NRas驱动的肝癌发生中,Foxo1不是AKT信号的下游效应者(图片源自Cancer Research )
另一个关键AKT相互作用因子是TSC2。其通过负向调控mTORC1(活化AKT信号的关键下游靶点)来抑制HCC发展。尽管多项研究证实活化mTORC1对AKT驱动多种肿瘤类型(包括HCC)的癌变过程具有必要性,但有限数据表明mTORC1激活本身不足以完全实现AKT诱导肝脏肿瘤发生的能力。GSK3是由GSK3α和GSK3β两种亚型组成的丝氨酸/苏氨酸激酶,AKT通过磷酸化GSK3α第21位丝氨酸和GSK3β第9位丝氨酸抑制其活性。多数研究提示GSK3在肝癌发生中发挥肿瘤抑制作用:与正常肝组织或癌旁组织相比,HCC病灶中GSK3β表达降低或磷酸化GSK3βSer9水平升高是其典型特征。迄今为止,GSK3α/β在介导AKT致癌作用中的功能意义尚未被深入探讨。本研究通过体外及体内小鼠模型,采用Akt/NRas诱导的HCC小鼠模型并结合人类HCC样本,系统阐述了AKT在肝癌发生过程中执行致癌程序的分子机制。
原文链接:https://doi.org/10.1158/0008-5472.CAN-25-1615
