垂体神经内分泌肿瘤(PitNETs)的病理特征是神经内分泌功能失调和全身激素稳态破坏,但其对外周免疫网络的调节作用仍不清楚。
2025年11月18日,上海交通大学吴哲褒、陈赛娟及叶幼琼共同通讯在Signal Transduction and Targeted Therapy 在线发表题为“Multidimensional tumor-blood profiling uncovers systemic lymphocyte-monocyte imbalance in pituitary neuroendocrine tumors”的研究论文,该研究系统地分析了来自883个PitNET肿瘤、108个PitNET相关外周血单核细胞(PBMC)样本和175个健康PBMC对照的大量RNA测序(RNA -seq),并结合了69个单细胞RNA测序(scRNA-seq)样本,包括肿瘤、正常垂体、肿瘤源性垂体和正常PBMC。该研究在PitNET患者中发现了系统性免疫失衡,其特征是循环淋巴细胞比例增加,伴随着细胞因子-受体相互作用特征的上调。
值得注意的是,肿瘤切除逆转了这种不平衡,单核细胞和中性粒细胞计数的正常化支持了这一点,流式细胞术和来自600个样本(200名健康对照和200名PitNET患者,术前和术后随访)的常规血液数据证实了这一点。轨迹分析确定了终末分化、分泌特化的细胞群,具有谱系特异性激素和细胞因子的高分泌。配体受体推断表明这些肿瘤衍生因子可能参与循环免疫细胞受体。基于PBMC转录组的随机森林分类器区分了PitNET亚型,强调了外周免疫特征的诊断潜力。此外,在雌激素诱导的大鼠模型中,PRL水平升高与相同的外周免疫偏斜相吻合。总的来说,该研究提供了一个有价值的资源,并证明PitNETs可以是全身免疫调节剂,其中内在激素分泌活性和单核细胞-淋巴细胞失衡共同驱动外周免疫功能障碍。
垂体神经内分泌肿瘤(PitNETs)起源于垂体前叶的激素分泌细胞,是一类独特的原发性颅内肿瘤,具有内分泌和肿瘤学意义。流行病学数据估计,其发病率约为每年每10万人4.54例,占所有原发性脑肿瘤的17.2%,是仅次于脑膜瘤的第二大常见颅内肿瘤。2022年世界卫生组织(WHO)分类将PitNETs的分子分层细化为三种转录因子驱动的谱系:PIT1谱系肿瘤(乳营养型、甲状腺营养型、生长营养型)、TPIT谱系(促皮质营养型)和SF1谱系(促性腺激素),其中非常小一部分无细胞肿瘤缺乏谱系特异性标记物。
临床上,PitNETs表现出双重特征。一方面,功能性PitNETs过度分泌催乳素(PRL)、促肾上腺皮质激素(ACTH)和生长激素(GH)等激素,导致催乳素瘤引起的不孕症、库欣病相关的代谢失调、肢端肥大症相关的器官肿大等全身性内分泌紊乱。另一方面,非功能性PitNETs约占病例的15-35%(主要在SF1谱系中),通常直到发生明显的肿块效应才被发现,导致双颞叶偏盲或脑神经麻痹等并发症。因此,PitNETs不仅仅局限于颅内病变,还可以作为全身性疾病调节剂,因此需要对其垂体外影响进行更广泛的研究。
PitNETs呈现出复杂的免疫微环境,显著影响肿瘤行为、治疗反应和预后。尽管以巨噬细胞和T细胞为主的免疫细胞浸润普遍较低,但特异性免疫相互作用仍然明显。例如,SF1系肿瘤中的CX3CR1+巨噬细胞通过INHBA-ACVR1B信号传导在免疫细胞的肿瘤凋亡中发挥微妙的作用。CD8+ T细胞浸润在生长激素分泌腺瘤(GHomas)中非常普遍,与肿瘤侵袭性呈负相关,预示着对生长抑素类似物的更好反应。相反,SF1系促性腺激素中的肿瘤浸润T细胞通过释放免疫抑制细胞因子(如IL-10)促进免疫逃避。高巨噬细胞浸润与较大的侵袭性肿瘤有关,而NK细胞数量减少表明侵袭性PitNETs的免疫监视减弱。
免疫谱分析,特别是CD8+ T细胞、PD-L1表达和B细胞浸润可以预测免疫治疗的疗效。其中,CD8+效应T细胞和记忆T细胞通过释放IFN-γ和TNF-α表现出较强的细胞毒性,其较高的丰度与侵袭性降低和更有利的临床结果有关。此外,肿瘤来源的细胞因子和趋化因子包括CXCL1、CCL2、CCL5和CXCL12,它们通过募集和极化免疫细胞、调节血管生成和影响上皮-间质转化来塑造肿瘤微环境。这些发现强调了免疫靶向治疗的潜力,例如PD-1/PD-L1抑制剂和CAR-T细胞疗法,特别是针对侵袭性无功能PitNETs。此外,作为内分泌活动性病变,PitNETs可能发挥更广泛的全身免疫调节作用。
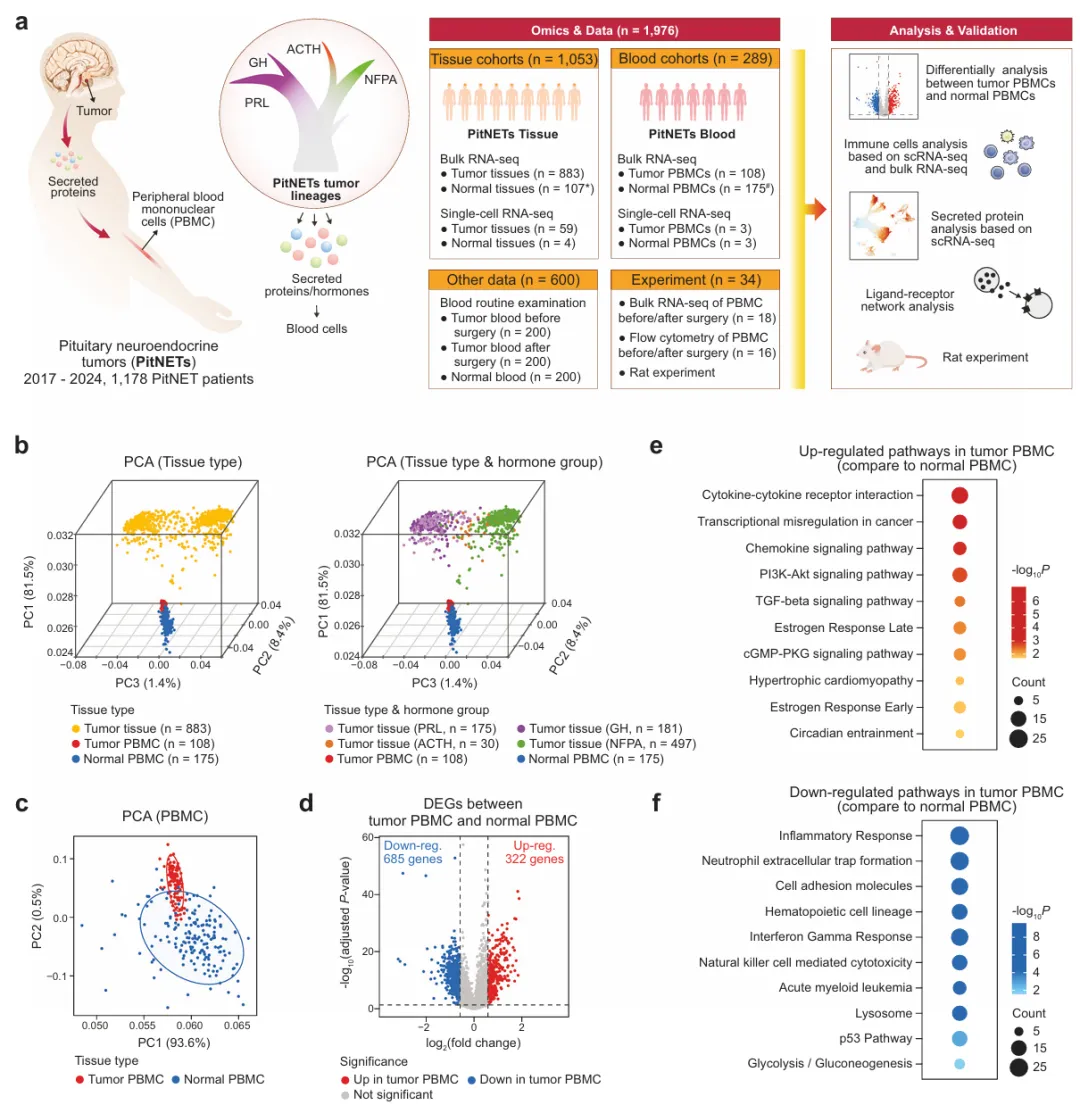
研究设计概述和路径特征(图源自Signal Transduction and Targeted Therapy )
外周血单个核细胞(PBMCs)是全身免疫的移动哨兵,因此可以作为肿瘤-宿主相互作用的介质和生物标志物。PBMCs的动态变化在各种癌症免疫治疗中显示出预后价值。例如,在接受派姆单抗治疗的肝细胞癌患者中,应答者表现出向细胞毒性CD8+ T细胞的免疫谱转移,而无应答者则表现出CD14+和CD16+单核细胞的增加。此外,PBMCs中CD4+CD25+FOXP3+调节性T细胞(Treg)的频率与免疫治疗结果相关,基线Treg水平较低的患者生存期较长。PBMCs衍生的免疫细胞可通过直接细胞毒性、免疫检查点调节、细胞因子产生和旁观者效应四种机制发挥抗肿瘤活性。然而,PitNETs是否会同样重塑PBMC的动态仍然是未知的。因此,整合来自肿瘤组织和外周免疫成分的知识可以提供对PitNET进展的更全面的了解,并有助于识别疾病监测的新生物标志物。
为了解决这一差距,研究人员进行了一项多维研究,将肿瘤组织概况与外周血免疫数据结合起来。通过对883个肿瘤、108个PitNET PBMC样本和175个健康对照者进行大规模RNA测序(RNA-seq);对59份肿瘤样本、4份正常垂体、3份PitNET PBMC样本和3份健康个体PBMC样本进行单细胞RNA测序(scRNA-seq);并通过流式细胞术、血常规检查和术后PBMC跟踪进行临床验证,绘制了PitNETs的全身免疫景观。分析表明,肿瘤谱系特异性分泌程序与PBMCs上相应的受体相互作用,扰乱淋巴细胞和髓细胞群的平衡,这可以通过肿瘤切除来逆转。与雌激素驱动的大鼠模型相补充,发现PitNETs是肿瘤-外周免疫轴的关键调节剂,其中分泌配体(例如,谱系特异性激素或趋化因子)直接影响循环免疫细胞。这项工作将PitNETs重新定义为免疫调节实体,并将PBMCs定位为动态生物标志物,为针对激素免疫串扰的治疗策略提供了框架。
参考消息:https://www.nature.com/articles/s41392-025-02489-0
