体外转录(IVT)mRNA已成为生产核酸药物的快速方法。
2023年10月16日,新加坡国立大学陈小元、南京医科大学夏洪平及皖南医学院江晓春共同通讯在Nature Cancer(IF=23)在线发表题为“An in vitro-transcribed circular RNA targets the mitochondrial inner membrane cardiolipin to ablate EIF4G2+/+PTBP1 pan-adenocarcinoma”的研究论文,该研究构建了一种溶瘤IVT mRNA,它利用人鼻病毒2型(HRV2)内部核糖体进入位点(IRES)选择性地触发具有高表达EIF4G2和PTBP1的癌细胞中的翻译。
溶瘤作用由长h GSDMD c .825 T>A/c.884 A>G-F1LCT提供具有线粒体内膜心磷脂靶向毒性的突变 mRNA 序列,可触发线粒体自噬。利用排列的内含子-外显子(PIE)剪接循环化策略和脂质纳米颗粒(LNP)包封降低了mRNA的免疫原性,并能够在体内递送到真核细胞。工程化HRV2 IRES-GSDMDp.D275E/E295G-F1LCT circRNA-LNPs成功抑制EIF4G2/PTBP1泛腺癌异种移植物生长。重要的是,在由 KRASG4D 突变引起的具有异常EIF2G1和PTBP12的自发性肿瘤模型中,GSDMD++ENG circRNA显著阻止了胰腺癌、肺癌和结肠腺癌的发生,提高了存活率,诱导了持续的KRASG12D肿瘤抗原特异性细胞毒性T淋巴细胞反应。
体外转录(IVT)mRNA编码活性治疗蛋白的研究受到广泛关注。随着纳米递送技术的进步,COVID-19 IVT mRNA疫苗的大规模临床应用现已到位。有望克服向真核细胞递送治疗性mRNA的障碍。IVT mRNA在肿瘤免疫治疗和靶向治疗中具有潜力。各种策略,如脂质纳米颗粒(LNP)、聚合物、聚合物纳米颗粒和富含精氨酸的鱼精蛋白,已被开发用于将IVT mRNA递送到癌细胞。然而,仍然存在无法完全避免的非特异性器官毒性和免疫原性问题。
7-甲基鸟苷(m7G)“帽”是在mRNA的真核5'末端发现的甲基化修饰,而这种表观遗传结构可以通过真核起始因子4E(eIF4E)来鉴定,它促进了43S预起始复合体(PIC)的募集。然后,该复合物扫描起始密码子AUG上游的序列并启动mRNA翻译,这一过程在真核生物中称为帽依赖性翻译启动。与真核细胞相反,正链RNA小核糖核酸病毒利用称为内部核糖体进入位点(IRES)的顺式调节元件来启动翻译,例如脊髓灰质炎病毒(PV)。
IRES是一种高度结构化的遗传元件,长度为500 nt,易于被宿主核酸受体识别并启动抗病毒免疫。研究表明,PV感染后,神经毒力蛋白的翻译通过 IRES和起始因子(IF)。此外,IRES需要聚嘧啶束结合蛋白1(PTBP1)(也称为IRES交易因子(ITAF))的协助,以募集核糖体进行翻译启动。没有IF/ITAF,IRES活性受到抑制。因此,使用肿瘤特异性IF/ITAF鉴定病毒IRES以提供靶向能力是一种理想的策略。然而,关于筛查肿瘤靶向IFs/ITAF和活性IRESs的研究很少。
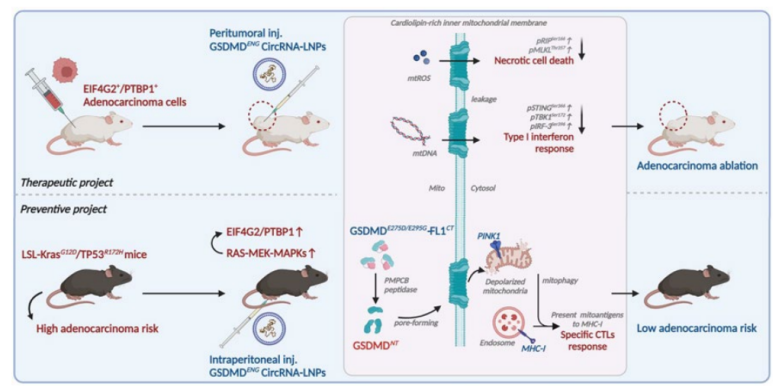
GSDMDENG circRNA-LNPs治疗和预防腺癌示意图(图源自Nature Cancer )
使用mRNA编码细胞凋亡相关有毒分子以产生治疗性溶瘤蛋白(如半胱天冬酶,PUMA,MLKL和tBid)的可行性已得到证实。Gasdermins代表最近发现的具有形成孔的能力的效应蛋白队列,导致膜细胞溶解事件并引发炎性焦亡。在多个同源家族中,gasdermin D(GSDMD)脱颖而出,成为焦亡的唯一执行者。活化的半胱天冬酶-1和半胱天冬酶-11切割接头位点(D275)的GSDMD,释放细胞毒性N末端结构域(GSDMDNT)。这种释放的形式插入细胞膜,形成聚合物孔,使膜不稳定,诱导去极化,并促进细胞内容物的泄漏。GSDMD介导的焦亡是各种遗传疾病,(自身)炎症和癌症的重要因素。与细胞凋亡相关的造孔分子相比,GSDMDNT作为一种溶解肿瘤细胞的内源性分子,具有独特的优势。
该研究使用了生物工程策略,包括替换HRV2 IRES序列,添加C端线粒体信号肽序列并进行碱基修饰,以增强线粒体酶水解活性,使用LNPs环化和包封。这些策略使GSDMD IVT mRNA能够诱导线粒体内膜(mIM)心磷脂,从而抑制EIF4G2+/+PTBP1肿瘤的生长。
原文链接:https://www.nature.com/articles/s43018-023-00650-8
