转录因子(TFs)通过其DNA结合域(DBDs)识别特定DNA序列,并利用效应域招募辅因子以调控基因表达。许多转录因子的效应域富含低复杂度区域(LCRs),这些区域往往由谷氨酰胺、丝氨酸或酸性残基组成,具有促成蛋白聚集的潜在风险。尽管LCRs在基因调控中发挥重要作用,但它们也可能导致异常聚集,例如多聚谷氨酰胺(polyQ)扩增已被证实与亨廷顿病等神经退行性疾病相关。令人关注的是,尽管许多人类转录因子本身也携带较长的polyQ序列,却很少出现毒性聚集现象,其机制尚不清楚。
近日,来自美国斯坦福大学医学院的Joanna Wysocka与Daniel F. Jarosz共同在Cell期刊发表题为DNA binding and mitotic phosphorylation protect polyglutamine proteins from assembly formation(DNA结合与有丝分裂磷酸化防止多聚谷氨酰胺蛋白聚集)的文章。研究揭示了FOXP2等富含谷氨酰胺的转录因子如何避免形成异常聚集。他们发现,DNA结合可在细胞间期抑制FOXP2聚集,而在有丝分裂期,特定的磷酸化事件可促进其从染色质上解离,从而维持其可溶性。此外,研究还指出,人类FOXP2所特有的氨基酸突变可降低蛋白的聚集倾向,提示调控蛋白溶解性的机制可能为治疗polyQ相关神经疾病提供新的策略。
FOXP2 是人类蛋白中含有最长连续多聚谷氨酰胺序列(polyQ,40个谷氨酰胺)的转录因子,在小脑和肺的发育过程中发挥关键作用,并与人类语言和言语能力密切相关。尽管 FOXP2 并未被直接归类为谷氨酰胺扩增相关疾病的致病因子,但研究人员在携带 FOXP2 突变的小鼠模型中发现了其在细胞核内形成聚集的现象。此外,FOXP2 中存在的两个人类特有的氨基酸变异——T303N 和 N325S,被认为与语言能力的演化有关。将这两种突变引入小鼠后,能够增强其神经可塑性并提升发声能力,进一步支持了其在语言进化中的功能意义。
DNA结合可抑制FOXP2与polyQ蛋白聚集,维持蛋白稳态
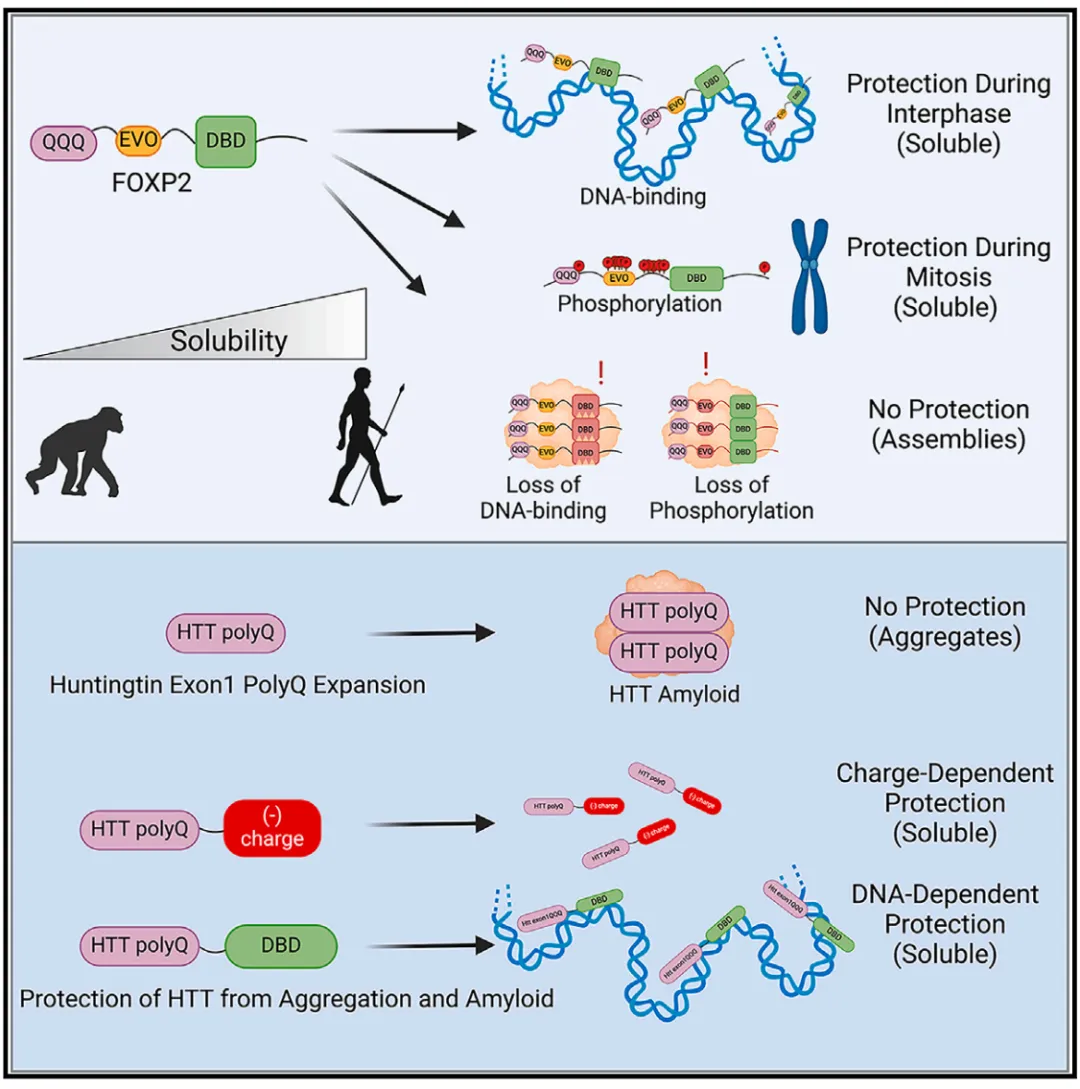
研究发现,FOXP2 是人类蛋白组中拥有最长连续 polyQ 序列的转录因子,尽管其序列长度已超过致病聚集的阈值,但野生型 FOXP2 在细胞中依然保持良好的可溶性。相比之下,与语言障碍相关的两种 FOXP2 突变(R553H 和 R328X)在细胞内易形成聚集体,并且这种聚集依赖其富含谷氨酰胺的结构域。进一步研究表明,FOXP2 的 DNA 结合能力对维持其可溶性至关重要。多种影响 DNA 结合的突变(如 R553H、Y540D、R583D)都会诱导聚集,而通过融合非特异性 DNA 结合结构域(如 SSO7D)或其他转录因子(如 SOX2 和 MAFK)的 DBD,能够显著恢复 FOXP2 的溶解状态,提示与染色质的结合本身即可抑制聚集。ChIP-seq 结果进一步证实,这些融合蛋白能够被重新定位至染色质。该机制同样适用于其他聚集倾向较高的转录因子(如 MEF2D、SOX5)及致病性 HTT-polyQ 蛋白,且聚集抑制效果取决于 DBD 的亲和力和 polyQ 序列的长度。这一发现揭示了 DNA 结合在维持富谷氨酰胺蛋白稳态中的普遍作用。
FOXP2可溶性调控机制揭示人类语言演化分子基础
研究进一步揭示了FOXP2在有丝分裂期的可溶性维持机制以及其潜在的调控方式。尽管FOXP2在细胞间期通过DNA结合维持可溶状态,但在有丝分裂期间被排除出染色质,仍未在胞质中形成聚集体,暗示其可通过一种独立于DNA结合的新型解聚机制维持稳态。值得注意的是,即便是DNA结合能力受损的突变体(如R553H),在有丝分裂中也呈现弥散分布,提示其聚集抑制可能依赖于胞质环境变化或主动的去聚集机制。进一步研究发现,FOXP2在有丝分裂期经历广泛的高磷酸化,尤其是在由CDK介导的SP/TP共识序列上,以及两个额外区域:EVO区(氨基酸292-343)和pre-FHD区(氨基酸438-465)。当SP/TP位点发生磷酸化缺失突变(11A)时,FOXP2在有丝分裂期无法从染色质释放,提示这些磷酸化事件对于FOXP2的解离是必需的。在R553H突变背景下进一步引入全磷酸化“失活”突变(30A)会阻止FOXP2聚集体在有丝分裂期间解散,说明SP/TP、EVO和pre-FHD区域的磷酸化协同调控FOXP2的聚集状态。令人兴奋的是,EVO区的磷酸化模拟突变不仅能够在细胞间期溶解FOXP2聚集体,还能抑制其截断体以及致病性HTT-polyQ蛋白的聚集,表明该机制有望转化为治疗聚集相关疾病的策略。此外,研究还发现人类FOXP2较小鼠和黑猩猩更不易形成聚集体,这种差异主要归因于EVO区的两处人类特异性氨基酸突变(T303N和S325N),其中T303N起关键作用,且与增强的纹状体突触可塑性密切相关。
综上所述,该研究以FOXP2为模型,揭示富谷氨酰胺转录因子可通过DNA结合和有丝分裂期的磷酸化机制维持蛋白可溶性,从而避免形成有害聚集体。此外,研究发现人类特有的T303N突变显著降低FOXP2的聚集倾向,提升其蛋白稳态,这一变化可能促进了突触可塑性的增强,并在语言能力的演化中发挥了关键作用。
原文链接:https://doi.org/10.1016/j.cell.2025.03.031
