Vγ9Vδ2 T细胞是主要的循环人类γδ T细胞亚群,通过跨膜 butyrophilins(BTN3A1、BTN3A2和BTN2A1)识别磷抗原(pAgs)对感染和肿瘤做出反应。
2025年6月12日,北京大学肖俊宇、张永辉共同通讯在Immunity(IF=25.5)在线发表题为“Structures of butyrophilin multimers reveal a plier-like mechanism for Vγ9Vδ2 T cell receptor activation”的研究论文,该研究解析了单独与微生物pAg HMBPP结合以及与T细胞受体(TCR)复合的BTN多聚体的结构。
这些结构揭示了BTN3A1和BTN2A1通过其细胞内B30.2结构域协同感知pAgs,而BTN3A2和BTN2A1在细胞外相互作用。TCR的参与触发其构象变化,允许BTN2A1横向结合Vγ9链,BTN3A2在顶端与Vδ2链的种系编码区和CDR3基序以及Vγ9 CDR3相互作用。该研究揭示了一种“钳子般的抓握”机制,其中BTN多聚体桥接TCR表面来驱动激活。这些发现为γδ T细胞靶向免疫疗法建立了结构基础,该疗法不同于依赖于主要组织相容性复合体介导的抗原呈递的αβ T细胞策略。
根据T细胞受体(TCR)的结构,T细胞可以大致分为αβ或γδ型。αβ T细胞识别结合在主要组织相容性复合体(MHC)或MHC样分子细胞外区域形成的凹槽内的抗原,这有利于与αβ TCRs直接相互作用。相比之下,γδ T细胞识别抗原的机制尚不清楚。人类循环γδ T细胞的主要亚群,称为Vγ9Vδ2 T细胞,已知对感染和肿瘤均有反应。这些T细胞可以识别产生活化“磷抗原”(pAgs)—非肽类异戊二烯代谢物,包括通用前体异戊烯基二磷酸(IPP)和二甲基烯丙基二磷酸(DMAPP)—的靶细胞,并且还可以识别含有更有效的pAgs的靶细胞,例如由外源(例如,细菌和寄生虫)产生的(E)-1-羟基-2-甲基-丁-2-烯基4-二磷酸(HMBPP)。
Vγ9Vδ2 T细胞独特地整合了先天免疫和适应性免疫。BTN2A1胞外域结合TCR Vγ9链的种系编码区域,使TCR的顶端表面未被占据。表位定位研究表明第二个配体结合位点涉及TCR的克隆型互补决定区(CDR)3区域。尽管BTN3A2和BTN3A3都缺乏功能性细胞内pAg结合结构域,但它们的胞外域与Vγ9Vδ2 TCR识别有关。然而,BTN3A亚家族蛋白(或可能是一些其他辅助分子)是否作为Vγ9Vδ2 TCR的配体(表面上位于克隆型CDR3区域)仍未解决。
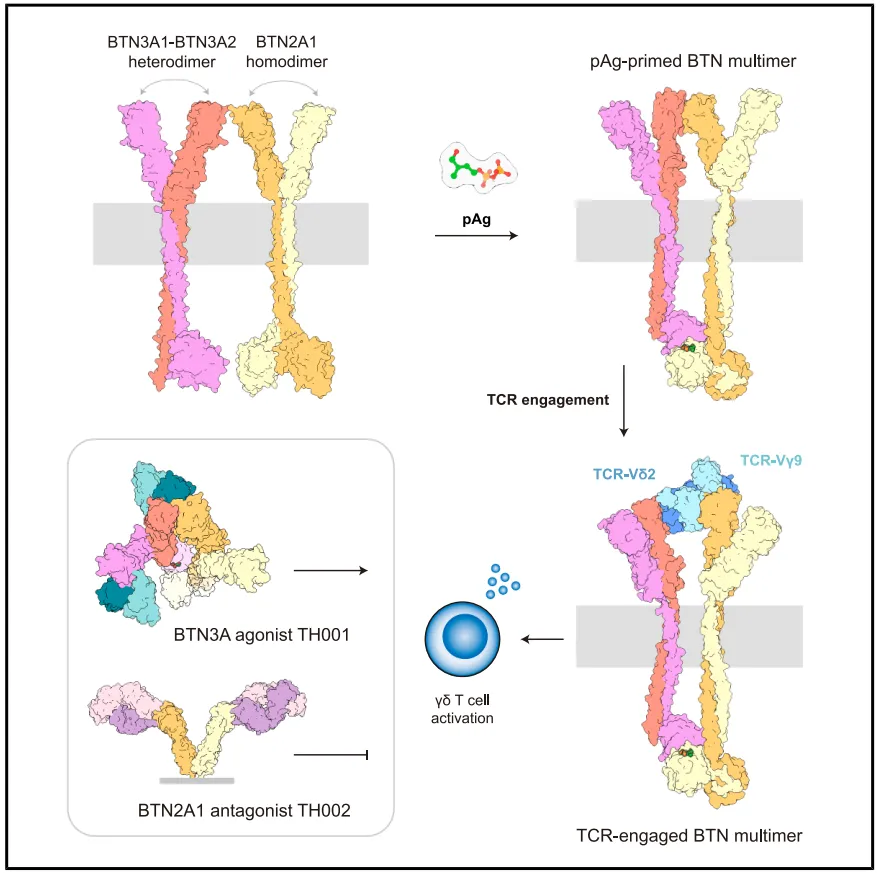
机理模式图(图源自Immunity)
在这里,研究人员对存在pAg的全长BTN蛋白的结构进行了研究,并描述了它们与Vγ9Vδ2 TCR的相互作用。具体来说,确定了BTN3A1-BTN3A2-BTN2A1多聚体的两种不同的冷冻电镜(cryo-EM)结构,一种仅与HMBPP结合,另一种与HMBPP和Vγ9Vδ2 TCR复合。HMBPP的功能是作为分子胶来稳定BTN3A1和BTN2A1的细胞内B30.2结构域之间的相互作用,而BTN3A2和BTN2A1胞外结构域之间的相互作用隐藏了与Vγ9Vδ2 TCR结合所需的表位。在Vγ9Vδ2 TCR接合时,TCR经历了实质性的构象变化,允许BTN2A1结合Vγ9链的侧面,而BTN3A2结合Vδ2链的顶面——包括其种系编码区和CDR3基序。
值得注意的是,BTN3A2也结合了Vγ9链的CDR3基序。除了揭示BTN3A2作为Vγ9Vδ2 TCR的真正配体外,我们的结构揭示了γδ TCR激活背后的钳样夹持机制。这种机制的特点是BTN3A和BTN2A1分别与不同的TCR表面区域结合,为Vγ9Vδ2 TCR信号的合理调节提供了基础,例如,在设计靶向γδ T细胞免疫疗法中。
参考信息:https://www.cell.com/immunity/fulltext/S1074-7613(25)00232-8
