病理性视网膜新生血管(RNV)是全球导致视力丧失的主要原因之一1。最常见的病因包括糖尿病视网膜病变和早产儿视网膜病变等,这些疾病影响着数百万人的视力2。这种病理性血管生长通常导致黄斑水肿、纤维化瘢痕形成等,是导致工作年龄人群和儿童人群失明的主要原因之一2-3。在病理因素刺激下,血管内皮细胞的失控出芽增殖是异常血管生长的起始机制4。血管内皮生长因子(VEGF)是关键致病因子,抗VEGF治疗新生血管性疾病取得重大突破,成为目前临床治疗RNV的一线药物,但随着广泛使用,很多患者发生药物抵抗现象6。因此,探索和寻找治疗RNV新靶点迫在眉睫。
内皮细胞蛋白C受体(EPCR)是一种单跨膜糖蛋白,主要在内皮细胞和干细胞中表达7。EPCR除了抗凝作用,还介导激活的蛋白C胞内信号传导,激活下游的蛋白激酶B(AKT)促进细胞生长,改善心血管功能8。EPCR阳性细胞谱系追踪表明,EPCR主要在视网膜血管内皮细胞中表达9。EPCR转录在血管生成的扩展阶段激活,但在静止阶段不表达,提示EPCR在视网膜生理性血管生成中的作用10。然而,EPCR在病理性视网膜新生血管形成中的作用仍不明确。
近日,上海市第一人民医院孙晓东与上海长海医院沈炜、宋洪元等合作在Nature Communications 杂志发表了题为Endothelial protein C receptor promotes retinal neovascularization through heme catabolism的研究文章。课题组在在增殖期糖尿病视网膜病变患者血清及玻璃体中临床样本发现EPCR配体水平明显升高。进一步建模发现EPCR在病理性视网膜新生血管中特异性高表达,而在正常视网膜血管中保持低转录特性。EPCR通过AKT及核因子(红细胞衍生2)相关因子2(Nrf2)调控内皮细胞血红素分解代谢,证实血红素分解代谢的产物一氧化碳是介导视网膜新生血管形成的关键分子。同时干预EPCR后不影响VEGF表达,提示EPCR通路不依赖于VEGF,阻断EPCR后明显抑制视网膜新生血管生成和内皮细胞增殖。上述研究结果得到进一步证实,发现标本中。该发现揭示了EPCR在视网膜新生血管形成中的关键作用,为抗VEGF抵抗患者的治疗提供了新靶点。
研究人员首先利用氧诱导小鼠视网膜病变(Oxygen Induced Retinopathy,OIR)模型对视网膜测序,发现EPCR在血管内皮细胞中明显高表达。利用Epcr-CreERT2小鼠与Rosa26tdT小鼠进行谱系追踪,发现EPCR在OIR小鼠视网膜中特异性表达在新生血管中。同时,收集增殖期糖尿病视网膜病变患者血清和玻璃体标本发现EPCR的配体活化蛋白C含量明显高于对照组。为进一步明确EPCR在RNV中的作用,研究人员利用Cdh5-CreERT2小鼠与Epcrflox/flox小鼠繁育出内皮细胞特异性敲除Epcr的小鼠EpcriΔEC。发现小鼠视网膜新生血管明显减少,同时视网膜血管发育也明显延缓。体内增殖实验显示,敲除内皮细胞Epcr后可以明显抑制体内血管内皮细胞增殖。为阐明EPCR调控RNV的分子机制,研究人员对敲减EPCR的内皮细胞进行测序分析,发现血红素加氧酶1(hmox1,HO-1)是差异最明显的基因。体内外敲减EPCR都可以明显降低HO-1的表达,而利用腺病毒过表达EPCR可以明显促进HO-1的表达。进一步发现EPCR通过AKT调控核因子红细胞系2相关因子2(NRF2)调节HO-1的表达。
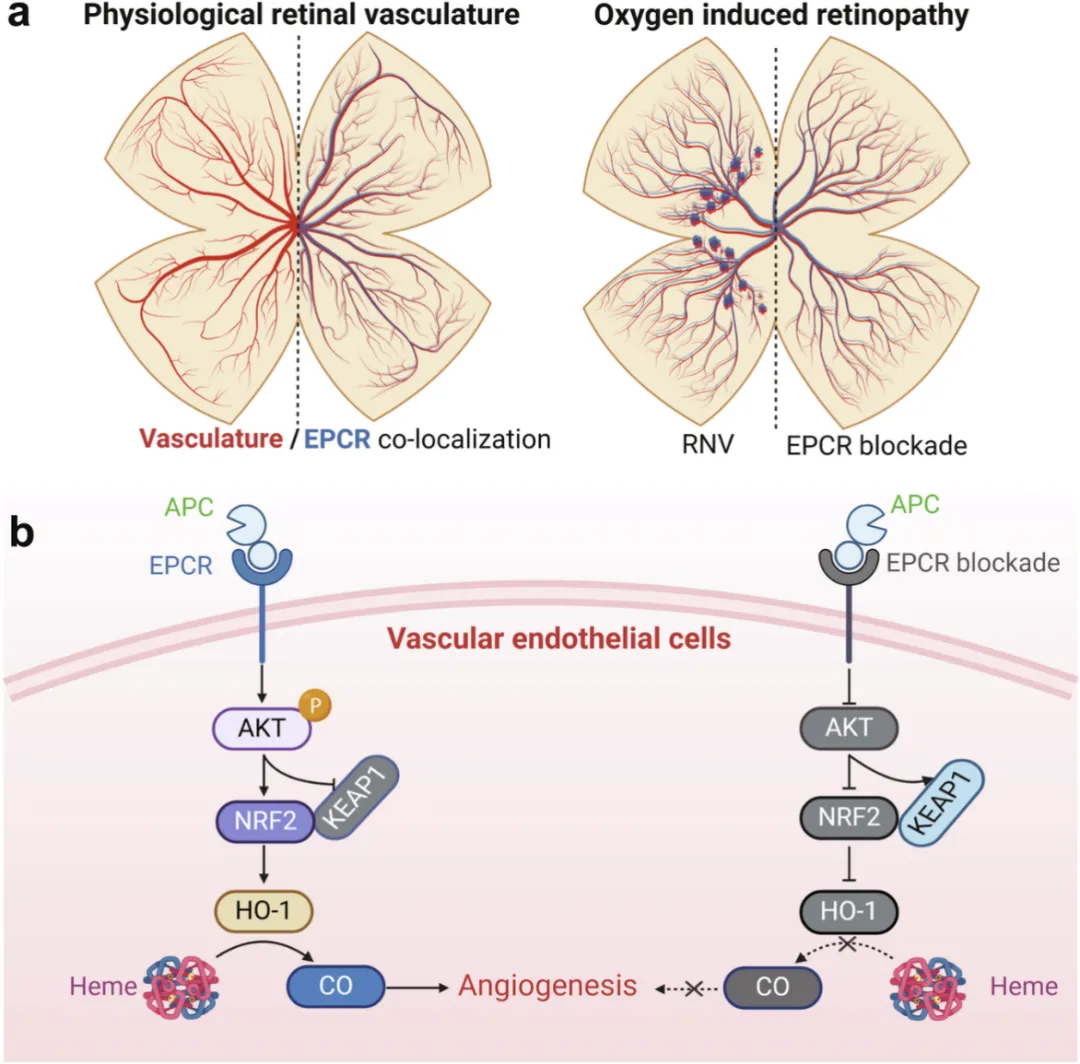
文章模式图(图源自Nature Communications )
HO-1是血红素分解代谢的关键限速酶,可以催化血红素分解代谢生成胆色素BV、一氧化碳(CO)和二价铁离子。为了证明HO-1介导的血红素分解代谢在RNV中的作用,研究人员利用条件性敲除内皮细胞Ho-1iΔEC小鼠及HO-1抑制剂ZnPPIX检测对RNV的影响。结果表明敲除内皮细胞Ho-1及ZnPPIX处理均可以明显抑制视网膜新生血管生成,提示血红素分解代谢在RNV形成中发挥重要作用。有研究证明CO对细胞具有一定保护性作用,同时也可以促进体外血管内皮细胞的增殖。因此,研究人员进一步探索了CO对RNV的影响。结果表明,内皮细胞敲除Epcr和Ho-1后视网膜新生血管减少,而补充CO可以明显改善血管减少表型,提示CO是EPCR调控RNV生成的关键分子。
综上所述,该研究发现EPCR在视网膜新生血管中特异性高表达,阻断EPCR通路可以明显抑制RNV形成。机制上,EPCR通过调控HO-1表达,及血红素分解代谢产生的CO促进RNV生成。增殖期糖尿病视网膜病变患者血清和玻璃体中EPCR配体含量明显升高,提示靶向EPCR可能是治疗RNV的潜在分子。特别是EPCR仅在增殖性血管内皮细胞中高表达,靶向EPCR治疗全身及局部副作用低。同时干预EPCR后不影响VEGF表达,提示EPCR通路是不依赖于VEGF通路,为抗VEGF耐药患者的治疗提供了新靶点。
原文链接:https://www.nature.com/articles/s41467-025-56810-0
