多细胞生物体体表以及粘膜表面通常定植有特定种群的共生微生物,被成为微生物群(microbiota),它们也可影响宿主的一些病理生理过程。这些微生物大部分都是定植在肠道的专性胞外细菌。一方面这些微生物对于宿主免疫系统的发育和成熟有重要作用,另一方面它们还可通过和一些细菌真菌竞争营养物质和生存空间或者产生抗菌物质来保护宿主免疫一些病菌的感染。但是微生物群如何影响病毒感染仍旧没有研究清楚,在不同的研究背景下,微生物群能否促进或抑制机体抗病毒免疫反应仍未有定论。
I型干扰素(Type I interferons, IFN-Is)对于机体抗病毒免疫具有重要作用,其在机体遭受感染过程中IFN-Is会大量产生,但机体在静息状态也会产生少量的IFN-Is。这些基础水平IFN-Is的产生使机体免疫系统维持一种预警状态以对感染和其他危险信号产生有效反应。而IFN-Is通常由三种主要的天然免疫途径所诱导产生,胞质膜或内体膜上的Toll样受体(Toll-like receptors,TLRs),胞内的RIG-I样受体(Rig-I-like receptors,RLRs)RNA识别通路,以及胞质中的DNA识别通路cGAS/STING。
过去十年,很多研究都表明微生物群在IFN-Is 产生诱导中发挥作用。目前,关于微生物群有何诱导IFN-Is的产生主要关注TLRs的作用,且存在相反的结论。例如,有研究表明,微生物群导致的IFN-Is的产生是由于细菌糖脂激活TLR4引起的,而另一些研究表明是细菌代谢物激活TLR7促进IFN-I产生,而其他TLRs并不起作用的。还有一些研究表明,TLRs下游通用接头蛋白的缺失并没有导致基础IFN-Is水平的降低。因此,哪种天然免疫受体参与到机体感受微生物群以及促进IFN-Is的产生仍旧未知。另外,在机体与外界的屏障表面,这些专性胞外微生物如何和远端的免疫细胞交流通讯来发挥系统性的免疫调节作用也有待研究。
2022年5月10日,来自瑞典Umea˚ University的Nelson O. Gekara团队在Immunity上发表题为The gut microbiota primes systemic antiviral immunity via the cGAS-STING-IFN-I axis的文章,通过一系列基因敲除小鼠,发现肠道菌群通过激活机体的cGAS-STING信号通路维持机体静息状态下基础水平IFN-I的产生,这对机体抵抗DNA和RNA病毒感染都具有重要作用。这种微生物群引起的cGAS-STING-IFN-I激活并不需要宿主细菌的直接相互作用,而是通过细菌来源的膜囊泡远程地将细菌DNA运输至宿主细胞中。
有时人们会自己服用一些抗生素来自我治疗一些疾病。一些医生也会给一些病毒感染患者开处抗生素来预防病毒感染之后常常伴随出现的细菌感染。但是,抗生素的使用会影响肠道菌群,这些抗生素的使用是否会影响病毒感染的康复是值得研究的问题。为研究这一过程,研究者给小鼠口服氨苄青霉素,新霉素和万古霉素等混合抗生素。两周后对小鼠粪便16S rDNA测序,发现抗生素处理的确显著降低了小鼠肠道细菌的丰度。随后通过滴鼻或者腹腔注射使小鼠肺部或者系统性感染DNA病毒单纯疱疹病毒(herpes simplex virus type 1,HSV-1),发现抗生素处理小鼠病毒复制更高且临床症状更严重。这表明肠道共生的细菌能够促进机体包括远端器官的抗病毒反应。基础水平的IFN-Is对于机体抵抗病毒感染具有重要作用。为探究抗生素使用加重病毒感染是否和共生菌对IFN-Is的激活有关,研究者利用Ifnb1荧光素酶报告小鼠(Ifnb+/Δβ-luc)监测IFN-Is的水平。发现抗生素处理在静息状态下导致小鼠系统性的IFN-I基础水平下降,以及组织中干扰素刺激基因和促炎细胞因子表达下降,这或许是抗生素抑制机体抗病毒反应的原因。
肠道共生菌和宿主之间的相互作用需要很好的调控以维持肠道共生菌和宿主之间的互利共生关系,并避免引起病理性的免疫反应。例如,肠道粘膜层提供了物理隔离。此外为避免肠道菌群引起的过度激活,消化道上皮细胞要么表达非常低水平的TLRs或者只在不朝向细菌的基地外侧表达TLRs,且小肠表皮细胞中的TLRs信号被高度抑制。不像致病菌,共生菌通常是无毒的且不会破坏宿主粘膜屏障去深入组织和免疫细胞接触的。更重要的是,共生菌通常产生修饰过的微生物相关分子模式,它们会抑制而不是激活TLRs信号。尽管存在这么多的宿主和微生物相关因素,在宿主屏障远端的共生细菌如何能在机体中引起系统性的IFN-Is反应来抵抗病毒感染呢?此外,又是哪一种天然免疫信号通路参与其中?
为研究清楚这一问题,研究者接下来在Ifnb1荧光素酶报告小鼠中敲除一系列IFN-Is产生的天然免疫通路信号蛋白,观察其对静息基础水平IFN-Is产生的影响。发现TLRs下游接头蛋白TRIF和MYD88的敲除并不影响基础水平IFN-Is产生的影响,进一步敲除RLRs下游的MAVS也对基础水平IFN-Is产生的影响不大,而STING的敲除显著降低了基础水平IFN-Is的产生。抗生素处理之后,粪便移植可以恢复野生型小鼠的基础IFN-Is水平,而STING敲除小鼠的基础IFN-Is水平没有被恢复。这表明肠道微生物群引起IFN-Is的产生需要细胞内的STING信号通路。随后研究者发现这些肠道专性胞外共生细菌并不需要和免疫细胞的直接接触引起STING-IFN-Is的激活,而是通过细菌分泌的膜囊泡 (membrane vesicles,MVs) 激活STING-IFN-Is信号进而提高机体抵抗病毒感染的能力。进一步发现细菌膜囊泡内包裹着细菌DNA防止其被核酸酶降解,并将其传送至远传的免疫细胞中,激活细胞中的cGAS-STING-IFN-Is信号,来维持静息状态下基础水平的干扰素的产生。在小鼠的循环系统中也检检测到包裹着细菌DNA的细菌膜囊泡。且肠道菌群通过cAGS/STING介导的基础IFN-Is的产生也能够帮助机体抵抗RNA病毒水疱性口炎病毒(vesicular stomatitis virus,VSV)的感染,和抗生素处理小鼠类似,cGAS或STING敲除小鼠中基础IFN-Is的水平显著下降,而VSV感染后病毒的清除更慢。
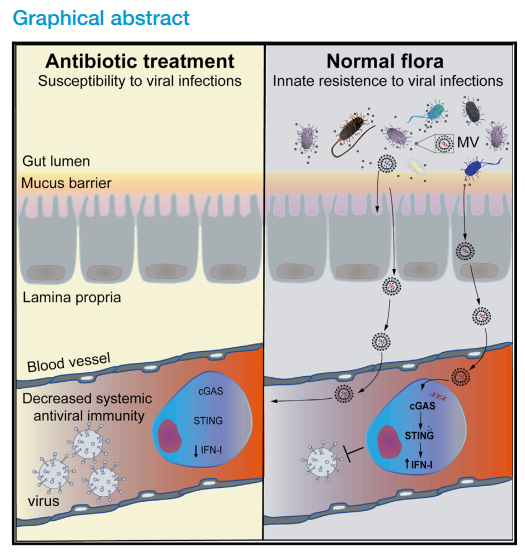
总之,本研究通过多种小鼠模型结合体内体外实验表明肠道微生物群或可通过细菌微囊泡将细菌DNA传递至远处的免疫细胞,激活细胞中的cGAS-STING-IFN-Is信号,维持一定基础水平的I型干扰素,提高机体应对病毒感染的能力,这也暗示抗生素的滥用或可影响增加病毒感染的风险。
