在哺乳动物的能量的平衡过程中,胰高血糖素受体(Glucagon receptor,Gcgr)在调节糖脂代谢中起着关键作用。肝脏葡萄糖生成(Hepatic glucose production,HGP)是系统葡萄糖稳态的重要生理过程。Gcgr是肝脏中以高血糖素作用的主要调节剂。Gcgr信号通路对葡萄糖生成和脂质利用的联合下游效应限制了Gcgr作为II型糖尿病治疗靶点的潜力,因为使用抑制剂会降低高血糖进而导致脂肪肝和血脂的异常。因此,详细解析Gcgr的作用信号机制、产生有针对性的小分子药物将很有必要。
近日,德国慕尼黑糖尿病与癌症研究所Anja Zeigerer研究组在Cell Metabolism上发表了文章Vps37a regulates hepatic glucose production by controlling glucagon receptor localization to endosomes,发现肝细胞中核内体Vps37a会减少导致Gcgr的内体积累,同时减少其在溶酶体中的存在,导致肝脏葡萄糖生成通路的优先激活,而不影响脂肪酸的氧化。该工作表明Vps37a在Gcgr转运中具有独特功能,是特异性调控Gcgr的新靶点。
鉴于ESCRT-I复合体在非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)以及非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)进展中的作用【4】,作者们希望研究ESCRT-I组分在肝脏代谢调节中的作用。ESCRT-I是一种异四聚体复合体,包括Tsg101、Vps28、Vps37a-d以及辅助蛋白UBAP-1【5】。通过对健康人肝脏以及具有肝脏疾病的患者肝脏中ESCRT-I组分表达进行分析,作者们发现VPS37A在NAFLD中具有特定的作用,其中VPS37A低水平与肝脏健康损害相关。由于NAFLD的严重程度通常与II型糖尿病的发病率增加有关【6】,作者们进一步地度II型糖尿病患者中ESCRT-I的表达进行了筛查,发现VPS37A表达明显降低了56%,VPS37B也会明显降低,但ESCRT-I的其他成员没有变化。这些结果提示作者们VPS37A在II型糖尿病以及非酒精性脂肪性肝病中发挥着关键作用。
为了探索Vps37a的代谢作用,作者们通过尾静脉注射包含Vps37a siRNA的脂质纳米颗粒在小鼠肝细胞中沉默Vps37a,发现肝脏中出现特异性的糖异生激活以及肝脏中葡萄糖的产生。通过使用Vps37aKD小鼠,作者们发现Vps37a的减少导致胰高血糖素信号cAMP/PKA/p-Creb通路过度激活,但是不会影响脂质信号通路的稳态。
肝脏中cAMP/PKA/p-Creb信号通路的激活以及糖异生信号通路的诱导受到Gcgr的调控。为此,作者们在小鼠肝脏中特异性敲除GcgrKO,发现GcgrKO小鼠的肝脏细胞中Vps37a减少50%,从而导致基础水平和胰高血糖素刺激下的p-Creb激活增加,从而证明了Vps37a敲低的表型依赖于Gcgr。进一步地,作者们发现在喂食高脂肪食物的小鼠中,Vps37a的减少会导致高血糖和胰岛素抵抗,但是脂质代谢过程在Vps37a敲低后并不会受到影响。
那么Vps37a以及Gcgr之间是如何调节的呢?先前的研究表明Vps37a调节早期到晚期内体转运,而其在代谢中的作用依赖于Gcgr,因此作者们推测Vps37a可能在Gcgr转运和信号转导中发挥作用。为了验证这一假设,首先作者们发现Vps37a与Gcgr有特异性的相互作用。其次,Vps37a有一个公认的泛素结合域,然而,目前还没有发现直接泛素化的货物。为了检查GCGR是否经历泛素化介导的核内体内化,GCGR与泛素点状信号存在共定位,随着胰高血糖素处理会增加,这说明GCGR部分泛素化因而可能会被Vps37a送去降解。随后,作者们发现在Vps37aKD后会造成Gcgr在核内体的累积,而cAMP/ PKA/p-Creb介导的糖异生激活需要Gcgr的核内体定位。
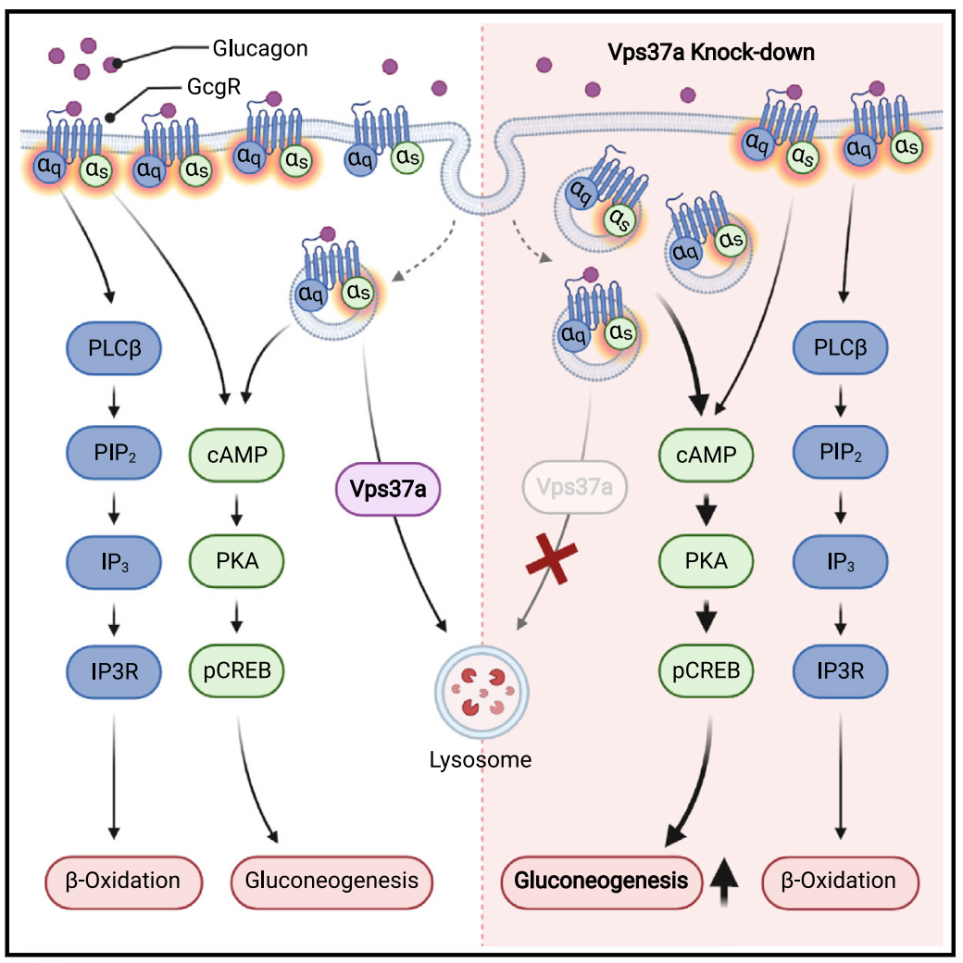
图1 工作模型
总的来说,作者们的工作发现肝细胞特异性敲低Vps37a会导致核内体中Gcgr的积累,进而导致cAMP/PKA/p-Creb信号通路的过度激活促进糖异生,但此过程不会影响脂质代谢。高脂肪饮食喂养的动物中Vps37a的敲除会导致高血糖,这些数据揭示了核内体信号通路对代谢性疾病的重要性以及挖掘了潜在的II型糖尿病治疗靶点。
原文链接:https://doi.org/10.1016/j.cmet.2022.09.022
