关节腔传统上被认为是无菌环境,但随着多组学技术的发展,这一认知被彻底颠覆。微生物群落在众多曾被认定为无菌的组织中不断被发现,使得关节腔成为潜在的微生物定植位点。然而,关节内微生物在骨关节炎(OA)中的存在及其作用仍鲜有研究。
2025年11月16日,南昌大学郝亮及陈廷涛共同通讯在Advanced Science(IF=14.1)在线发表题为“Synovial Fluid-derived Micrococcus Luteus G18 Exacerbates Osteoarthritis Progression by Promoting Chondrocyte Degradation via TLR2/JNK/AP-1 Signaling Pathway”的研究论文。研究通过16S rRNA高通量测序分析了不同阶段OA患者的滑液微生物组,结果显示微生物多样性与OA进展呈正相关,其中微生物组以变形菌、坚壁菌和放射菌为主。
培养可产生145个菌株,其中藤黄微球菌(M.luteus)在晚期OA患者中显著富集。在OA大鼠模型中,关节内移植关节液微生物群或藤黄微球菌G18菌株可加剧软骨损伤。机制上,藤黄微球菌G18通过表面肽聚糖激活TLR2/JNK/AP-1信号通路,破坏软骨细胞稳态,进而抑制细胞外基质(ECM)合成并促进其降解。这些研究结果不仅首次提供了关节腔微生物群存在的全面证据,还揭示了藤黄微球菌G18是OA进展的微生物驱动因子。本研究重塑了对OA发病机制的认知,并为基于微生物的诊断与治疗开辟了新方向,指向关节生物学中一个此前被忽视的维度,值得进一步深入探索。
骨关节炎(OA)是一种广泛存在的慢性退行性关节疾病,主要表现为软骨退化、骨质形成以及滑膜炎症。作为慢性疼痛、行动受限和身体残疾的主要因素,对全球公共卫生构成了重大挑战。骨关节炎的发病机制多因素,然而当前模型未能充分阐明其复杂机制。因此,识别新的分子和细胞途径对于克服现有治疗挑战、发现新的诊断标志物和治疗靶点至关重要。OA的发病机制与炎症、代谢失调、细胞外基质(ECM)合成与降解失衡以及异常免疫反应密切相关。关键的是,关节微环境的失调越来越被认识为骨关节炎进展的关键病理机制。关节微环境构成了一个高度动态的系统以维持正常条件下的稳态和关节健康。然而,感染、炎症或其他刺激导致关节微环境稳态的破坏会启动并延续骨关节炎的进展,其中炎症起着不可或缺的作用。微环境失衡的一个显著特征是促炎细胞因子的表达升高,而合成代谢因子则下调。这一过程会触发丝裂原活化蛋白激酶(MAPK)信号通路的一系列反应,导致基质金属蛋白酶(MMPs)激活,并促进软骨降解和软骨下骨重塑异常。因此,这些研究结果揭示了一个病理反馈环路:炎症介质破坏关节微环境、降解软骨基质并损害软骨下骨代谢,共同驱动OA 进展。传统上,关节腔被认为是无菌的微环境。然而,高通量测序和组学技术的发展挑战了这一观点,逐渐识别出关节腔内的微生物。具体而言,Qiu等人收集了23 名接受关节置换手术患者的肩关节软骨样本,通过16S rRNA 测序发现 74% 的样本中存在不动杆菌属和草酸杆菌科成员,表明肩关节组织中存在低丰度但稳定存在的微生物。此外,Cheng等人整合16S rRNA 测序、电子显微镜和培养组学技术,在晚期类风湿关节炎患者的关节液中鉴定出多种微生物群,证实了活菌的存在,并提出关节微生物群失调可能破坏软骨细胞糖胺聚糖代谢,进而促进软骨降解和关节炎进展。尽管如此,关于关节腔微生物群的研究仍较为匮乏,这些微生物在OA 中的精确组成、功能作用和病理影响仍不明确,这凸显了深入研究的迫切需求。
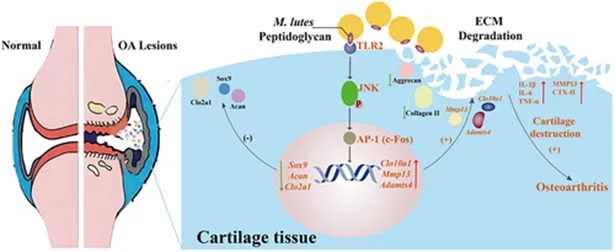
骨关节炎中关节液藤黄微球菌 G18 介导软骨退变的作用机制示意图(摘自Advanced Science )
本研究通过高通量测序综合分析了40名OA患者的滑液,分析了微生物组成,并通过培养组学关键确定了藤黄微球菌G18(M. luteus G18)作为潜在的关键病原体。此外,通过利用MIA诱导的OA大鼠模型和体外软骨细胞检测,研究明确证实藤黄微球菌 G18 通过激活 TLR2/JNK/AP-1 信号通路驱动软骨降解并加速 OA 进展。综上,研究结果为关节驻留微生物群在 OA 发病机制中的关键作用提供了有力的机制性证据,并为临床实践中开发基于微生物群的诊断生物标志物和靶向治疗策略提供了革命性的视角。
原文链接:https://doi.org/10.1002/advs.202514220
