细胞内存在不同的蛋白质量控制(Protein Quality Control)途径,用于降解错误折叠蛋白,以防止有害蛋白聚集。蛋白质量控制通路的退化或故障对众多年龄相关的人类疾病有重大影响,例如神经退行性疾病、癌症、糖尿病和各种代谢性疾病等。内质网作为蛋白质合成和折叠的重要场所,具有一套精细的质量控制系统。大部分在内质网腔内合成的蛋白需要经过糖基化修饰(glycosylation),这些新合成的糖蛋白如果错误折叠,则会被识别并从内质网中逆向转运到细胞质中,随后被多泛素化并降解,这个过程被称为内质网相关蛋白降解(ERAD)途径。ERAD在所有真核生物中保守,可以针对性地降解错误折叠蛋白,从而减轻细胞毒性应激。
内质网腔内的糖基化修饰发生在蛋白的糖基化位点(Asn-X-Ser/Thr)。含有3个葡萄糖、9个甘露糖、2个葡糖酰胺(Glc3Man9GlcNAc2)的糖链与新合成蛋白的天冬氨酸(ASN)连接,被称为N-连接糖基化。伴随蛋白折叠,这个糖链会依次被葡萄糖苷酶(glucosidase)、甘露糖苷酶(mannosidase)切割,形成Man8GlcNAc2 (简称Man8)。含有Man8的蛋白如果正确折叠,会被保留在内质网中成为驻留蛋白或进入下游分泌途径。如果蛋白依旧不能正确折叠,则会被另一个甘露糖苷酶Mnl1(哺乳动物同源物EDEM)识别并切割,形成含Man7的蛋白。Mnl1/EDEM的处理非常重要,因为在这一步骤后,错误折叠糖蛋白会被ERAD途径中的Hrd1复合物识别并逆向转运到细胞质,最终被蛋白酶体降解(图1)。作为ERAD途径的检查点(checkpoint),Mnl1/EDEM不可逆地将蛋白送到ERAD降解途径中。之前的研究发现,Mnl1/EDEM和蛋白二硫键异构酶(PDI)家族蛋白形成复合物。对于复合物形成的原因,以及复合物如何能识别错误折叠糖蛋白还不清楚。神秘的是,Mnl1/EDEM-PDI复合物似乎可以区别真正的ERAD底物和正确折叠的中间体,其中机制更是知之甚少。
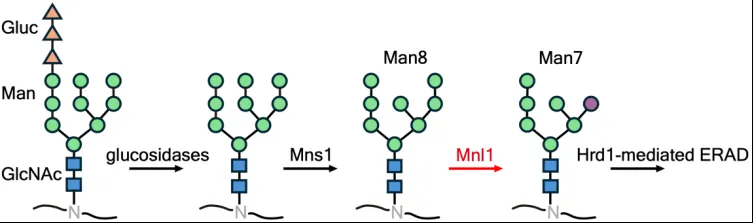
图1. 内质网中的糖链处理
2025年2月10日,哈佛医学院Tom Rapoport实验室(第一作者为赵丹博士)在Nature Structural & Molecular Biology杂志上以研究长文(Research Article)的形式发表了题为 Initiation of ERAD by the bifunctional complex of Mnl1/Htm1 mannosidase and protein disulfide isomerase的文章 。该论文揭秘了在酿酒酵母中由甘露糖苷酶Mnl1和蛋白二硫键异构酶(Pdi1)组成的复合物在ERAD起始过程的关键机制。通过一系列生化实验、体内试验和结构解析,作者阐释了Mnl1-Pdi1复合物如何招募错误折叠糖蛋白并忽略正确折叠的中间体。令人意外的是,复合物中的Pdi1可以作为还原酶对错误折叠糖蛋白的二硫键进行还原,从而帮助底物顺利通过下游Hrd1复合物形成的狭窄通道。本研究极大地促进了人们对内质网内糖基化过程的认识和理解,更代表了蛋白质质量控制领域的关键成果。
为了研究Mnl1的甘露糖苷酶活性,作者首先利用Man7和凝集素的特异结合建立了一种新型甘露糖苷酶活性检测方法(图2)。这种方法比以往的高效液相色谱(HPLC)或质谱鉴定更加便捷定量。随后,作者报告了活性Mnl1-Pdi1复合物的结构,Mnl1由经典的甘露糖苷酶结构域(MHD)、Loop区和C端结构域(CTD)组成,而Pdi1由四个硫氧结构域(Trx)组成(图3)。Mnl1的Loop区介导了Mnl1和Pdi1的三个Trx结构域的相互作用。破坏Mnl1和Pdi1相互作用界面的突变导致Mnl1形成不可溶聚集体(insoluble aggregates),从而引起ERAD底物降解的缺陷。为了进一步研究Mnl1-Pdi1复合体和底物的相互作用,作者利用核糖核酸酶(RNase B)构建了一系列不同折叠状态的蛋白,包括正常折叠蛋白(RB)、球状错误折叠蛋白(RBΔs和RBsc)以及完全未折叠蛋白RBun。利用上述酶活性测定方法,作者发现Mnl1-Pdi1复合物的底物是球状错误折叠蛋白(RBΔs和RBsc)。进一步研究发现,Mnl1的CTD结构域上的疏水区可以识别这些错误折叠蛋白。该疏水区的突变可以抑制Mnl1的甘露糖苷酶活性从而引起ERAD底物降解的缺陷。Pdi1可以改变Mnl1的CTD结构域的底物特异性,使Mnl1只识别球状错误折叠蛋白从而帮助其的糖链切割,并忽略未折叠的多肽链。
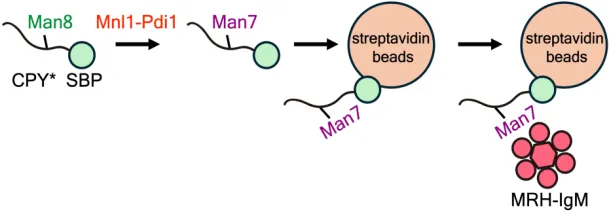
图2. 新型甘露糖苷酶活性检测方法
上述发现证明ERAD的底物是可能具有二硫键的球状错误折叠蛋白。实验室之前的研究显示,ERAD下游的Hrd1复合物形成的通道非常狭窄,很难想象这些球状蛋白如何通过Hrd1通道。由此可推断在ERAD途径中存在一个二硫键还原酶,事实上参与ERAD途径的还原酶已经在领域内被假设存在了很长时间,但人们一直没有找到专一参与这个过程的酶。作者发现,Mnl1-Pdi1复合物中的Pdi1无法接受内质网内巯基氧化酶Ero1传递的氧化力,因此其不能作为氧化酶存在。令人意外的是,复合物中的Pdi1可以在体外和体内依赖还原型谷胱甘肽(GSH)还原ERAD底物。在体内过表达Mnl1不仅可以极大促进ERAD底物的还原,而且可以回补GSH合成酶引起的ERAD底物降解的缺陷。
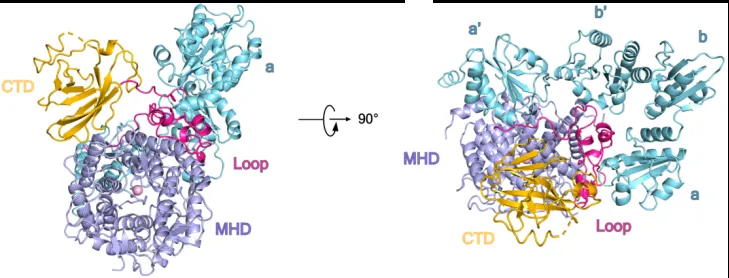
图3. Mnl1-Pdi1复合物的结构
本研究的结果展示了Mnl1-Pdi1复合物中在ERAD起始过程中的双重功能: 复合物中的Mnl1通过CTD结构域识别错误折叠糖蛋白从而帮助其进行糖链切割,Pdi1修饰Mnl1的底物特异性,导致Mnl1只能识别球状错误折叠蛋白而忽略折叠中间体例如新生多肽链等;Pdi1利用GSH还原球状错误折叠蛋白的二硫键从而帮助其顺利通过下游Hrd1通道。在偏氧化的内质网中,大部分氧化还原酶可能行使的是氧化酶活性,然而Mnl1的存在使Pdi1成为专一服务ERAD途径的还原酶。作为ERAD途径的关键检查点,Mnl1-Pdi1复合物因此招募并切割错误折叠蛋白的糖链,并还原错误折叠蛋白,从而帮助后续蛋白降解(图4)。同时,Mnl1的哺乳动物同源蛋白EDEM也与PDI家族蛋白相互作用,提示该机制的可能保守性。该研究也为将来设计基于Mnl1/EDEM的标的降解技术(PROTAC)提供重要理论基础。
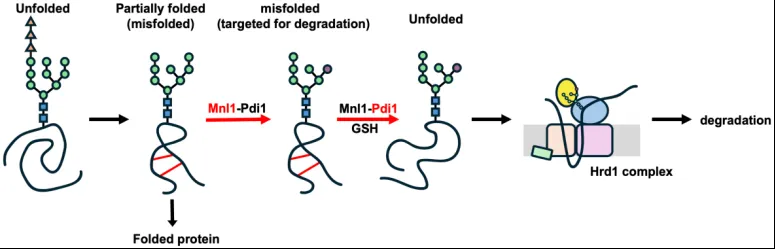
图4. Mnl1-Pdi1复合物在ERAD途径中的双重功能
原文链接:https://www.nature.com/articles/s41594-025-01491-y
