约10%的人类肝细胞癌(HCC)同时存在c-MET激活与β-连环蛋白功能获得性突变,这代表了一种具有临床相关性的HCC亚型。
2025年12月2日,四川大学王海川,西安交通大学徐蒙和夏威夷大学陈昕共同通讯在Hepatology在线发表题为“Targeting mTORC2-Dependent AKT/FOXO1/RNF125 signaling exploits a therapeutic vulnerability in c-MET-activated and β-catenin-mutated hepatocellular carcinoma”的研究论文。该研究在c-Met/β-cateninΔ90型HCC病灶中,mTORC2/AKT级联反应被激活。遗传性敲除mTORC2的关键亚基Rictor,能强烈抑制c-Met/β-cateninΔ90依赖的肝癌发生。机制研究表明,TSC2/mTORC1轴和FOXO1转录因子均在该模型中作为mTORC2/AKT的关键下游效应因子发挥作用。作者进一步鉴定出RNF125是FOXO1的直接转录靶标。
过表达RNF125能显著抑制c-Met/β-cateninΔ90模型的肿瘤发生,并在体外抑制肝癌细胞生长。值得注意的是,利用体内多西环素诱导系统,作者发现,在已形成的c-Met/β-cateninΔ90型HCC中诱导RNF125表达可抑制肿瘤进展,这表明激活RNF125可能对HCC治疗具有转化意义。综上,本研究首次确立了mTORC2/AKT/FOXO1/RNF125轴是c-MET激活/β-连环蛋白突变型HCC的关键驱动因子和治疗薄弱环节。本研究通过明确FOXO1在该特定HCC亚型中的肿瘤抑制作用,填补了一个关键空白。此外,该研究将RNF125定位为该侵袭性HCC亚型的一个有前景的治疗靶点。
肝细胞癌(HCC)是原发性肝癌最常见的组织学类型,在全球范围内发病率位居第六,是癌症相关死亡的第三大原因。靶向治疗和免疫检查点抑制剂已显示出前景,但大多数患者反应不佳或短暂,这凸显了需要更深入理解HCC发生与进展的分子机制。哺乳动物雷帕霉素靶蛋白(mTOR)是细胞生长、代谢和肿瘤发生的核心调控因子。mTOR以两种不同的复合体形式存在:mTORC1(包含mTOR、Raptor和mlST8)和mTORC2(包含mTOR、Rictor和mlST8)。mTORC1调控蛋白质合并、脂肪生成和自噬,而mTORC2主要通过激活AKT信号通路控制细胞存活与增殖。AKT通过磷酸化作用使多种肿瘤抑制因子失活。AKT的两个主要底物是TSC2和FOXO家族成员。
具体而言,AKT激酶磷酸化TSC2,导致TSC1/2复合体失活,从而解除对mTORC1的抑制。因此,AKT的激活会引发mTORC1的激活,研究已证实TSC2/mTORC1是HCC发病过程中AKT下游的主要致癌信号。此外,AKT磷酸化FOXO家族成员,导致这些转录因子从细胞核向细胞质发生核转位。FOXO家族包含六个基因(FOXO1至FOXO6),被认为是调控肿瘤代谢、诱导细胞周期停滞并促进细胞凋亡的肿瘤抑制因子。研究表明,在肝脏再生和胰岛素信号传导过程中,FOXOs(尤其是FOXO1)是AKT下游的关键信号分子。然而,FOXOs作为AKT下游效应器的功能贡献在很大程度上仍未明确。
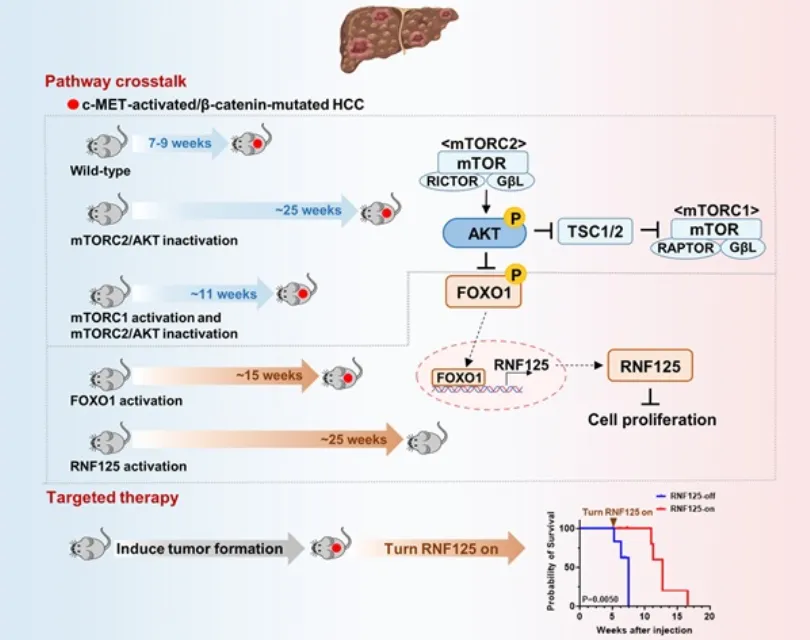
模式机理图(图片源自Hepatology )
RNF125(亦称TRAC-1)最初是在一项基于逆转录病毒载体的T细胞表面活化标志物筛选中被发现的。继发研究揭示了其作为RING指结构泛素E3连接酶的作用。RNF125已在多种癌症类型中被鉴定为肿瘤抑制因子。尽管其在多种恶性肿瘤中显示出治疗潜力,但RNF125的上游调控机制在很大程度上仍不清楚。受体酪氨酸激酶c-MET的持续激活与β-连环蛋白(由CTNNB1基因编码)的功能获得性突变,在大约10%的人类HCC病例中同时发生,这定义了一个临床相关且治疗选择有限的亚类。尽管PI3K/AKT/mTOR通路在HCC中常发生改变,但其在c-MET激活和β-连环蛋白突变致瘤过程中的确切作用仍知之甚少。在本研究中,作者探讨了mTORC2/AKT信号通路及其下游效应器在c-Met/β-cateninΔ90小鼠模型中的作用。重要的是,作者鉴定出RNF125是这一HCC亚型的一个新型潜在治疗靶点,为精准医疗开辟了道路。
原文链接:https://journals.lww.com/hep/10.1097/HEP.0000000000001637
