多发性硬化(multiple sclerosis,MS)是最常见的中枢神经系统自身免疫性疾病。在MS进展过程中,炎症持续刺激神经元导致神经变性和功能衰退。虽然免疫抑制剂可以调节浸润的免疫细胞,但并不能阻止进行性神经变性。既往观点认为神经元由于低表达炎症相关基因以及受限的形态和增殖能力被作为是神经炎症的被动接受者。最近的另一种观念正在向这种观点发起挑战,即神经元在感知细胞因子等压力后启动神经元炎症应激反应(neuronal inflammatory stress response, NISR)主动参与神经活动。最典型的例子是γ干扰素(interferon-γ,IFNγ),通过II型IFNγ受体诱导干扰素反应基因(interferon response genes, IRGs)募集吞噬细胞。除了细胞因子,神经元谷氨酸代谢紊乱导致的离子失衡也是一种神经压力。死亡的细胞或者激活的免疫细胞释放的谷氨酸通过胞内钙堆积导致兴奋毒性。
钙库操纵性钙内流(store-operated calcium entry,SOCE)广泛存在于众多非兴奋性细胞内的一种钙信号产生机制。各种刺激引起细胞内质网(endoplasmic reticulum,ER)向胞浆释放Ca2+,伴随ER跨膜Ca2+感知蛋白STIM转位至ER-胞膜连接点,进一步与钙释放激活钙通道结合,如ORAI1,导致钙内流。最近的研究揭示神经元ER钙释放导致的ER钙耗竭(ER calcium depletion,ERCa2+D)促进神经元的谷氨酸兴奋毒性。尽管如此,STIM蛋白的转位和炎性信号的关系对神经元的作用仍不清楚。
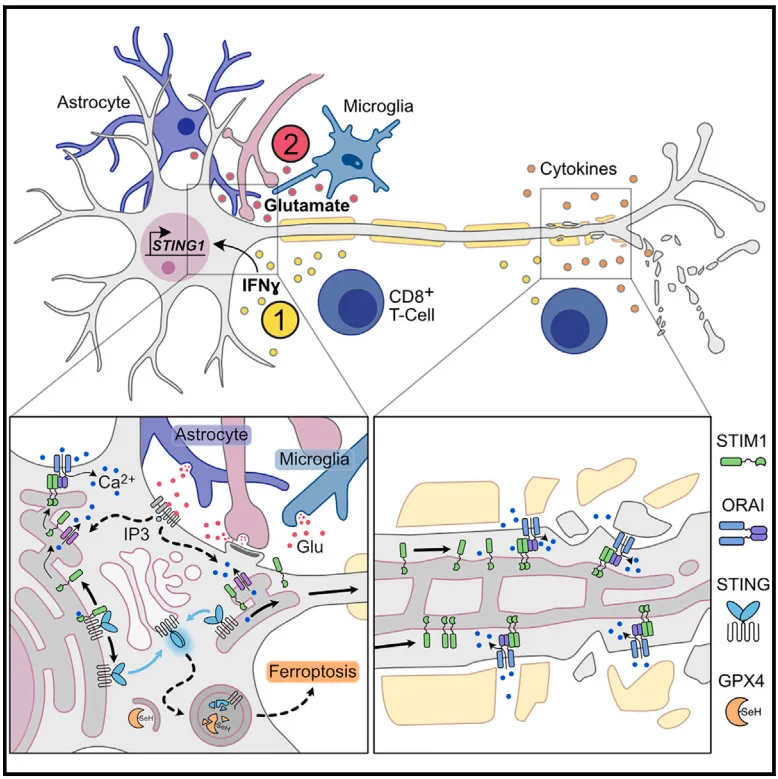
2024年6月14号,德国汉堡-埃彭多夫大学医学中心的Manuel A. Friese研究团队在Cell 杂志在线发表题为STING orchestrates the neuronal inflammatory stress response in multiple sclerosis的研究文章。该研究发现STING作为核心调节者以cGAS和IFN非依赖的方式通过整合干扰素和谷氨酸信号促进自噬介导的GPX4降解导致铁死亡,为多发性硬化相关的神经退行性疾病提供新的治疗靶标。
为了研究神经元STIM蛋白是否参与CNS炎症中的神经退行性病变,团队使用Cre-Loxp系统构建神经元特异性STIM1和STIM2敲除小鼠(Stim1-cKO和Stim2-cKO)。EAE造模发现Stim1敲除,而非STIM2敲除促进疾病进展,表明 Stim1可以抑制神经炎症造成的损害。此外,神经元胞体STIM1在人和小鼠EAE中蛋白表达降低,但mRNA水平没有变化。有意思的是,皮质神经元突触部分Stim1蛋白水平在EAE中增加,而这些运动神经元在脊髓背柱的轴突部分STIM1蛋白水平也增加,表明SOCE激活增加神经元轴突和突触部分STIM1蛋白水平。与此同时,作者发现STIM1优先定位在损伤轴突。总之,这些数据表明STIM1缺失增加神经元对炎症相关神经退行性的敏感性,此外神经元胞体STIM1在炎症时降低可能是由于STIM1转位至受损轴突或代偿性增加。
之后,团队发现在面临谷氨酸神经毒性时,神经元增加胞内Ca2+水平和ORAI介导的Ca2+内流并伴随内质网Ca2+水平的消耗(ERCa2+D);于此同时,STIM1+ 、ER+树突棘、STIM1+膜相关簇和STIM1-ORAI1共定位增加,表明谷氨酸神经毒性促进ERCa2+D和STIM1的膜定位并与ORAI1的结合。随后,作者在Glt25d2-EGFP/L10a小鼠急慢性EAE造模后经翻译核糖体亲和纯化测序发现Sting1显著诱导增加。考虑到STING与STIM1的结合以及在神经胶质细胞中的炎性作用,团队进一步研究STING在神经元中的效应。团队首先观察到神经元在基础状态下基本不表达STING,但在IFNγ刺激后显著诱导增加,表明STING蛋白选择性表达在炎性神经元。然而,经典STING下游分子,例如pIRF3、pNF-kB和pTBK,并没有在炎性神经元中增加,表明CNS炎症中经典STING通路并没有在皮质神经元中诱导。因此,作者假设STIM1的缺失可能导致STING的激活。作者首先使用IP证实神经元STIM1和STING存在结合,但ERCa2+D时结合显著减弱。进一步研究发现ERCa2+D不仅促进STIM1的膜转位,也促进STING的磷酸化。另外,STIM1的敲除也能促进STING的磷酸化。之后,作者在神经元通过病毒或延长IFNγ刺激等上调STING表达。上调STING表达的神经元对于谷氨酸神经毒性更为敏感,但当转染内质网驻留STING变体时可以废除这种效应,表明STING从内质网向高尔基体的迁移对于神经元的有害效应是至关重要的。有意思的是,神经元细胞在稳定状态下就存在可检测的pIRF3、pNF-kB和pTBK,且并不会在过表达STING和DMXAA刺激后进一步增加。另外,有无STING都不影响神经元对RNA类似物的IFN响应。体内实验也证实类似的现象,即STING并不影响神经元IFN应答。这些数据表明IFN经典通路在稳定状态下就有表达,且随着神经炎症进一步增加,但并不依赖STING蛋白。
基于上述发现,团队设想非经典STING信号通路,如自噬,在神经元中的作用。实验证实谷氨酸、ERCa2+D和DMXAA均能引起STING介导的自噬,且并不依赖TBK1活化和IFN诱导。相反,过表达不能与LC3结合的STING变体(STINGLIR7)和WIPI2结合的STING变体(STINGW2BD)则不能引起谷氨酸导致的自噬增加。另外,自噬抑制剂(3-MA、BafA1和SAR405)可以逆转STING过表达和Stim1-/-神经元对谷氨酸诱导的细胞毒性。这些均表明ERCa2+D激活STING介导的自噬促进神经元损伤。研究显示自噬依赖的细胞死亡主要涉及两种机制,包括Na+/K+-ATPase-依赖凋亡(autosis,自体死亡)和焦亡。乌本苷抑制Na+/K+-ATPase或Z-VAD-FMK抑制凋亡均不能逆转STING表达神经元对谷氨酸诱导细胞毒性的敏感性。有趣得是,谷氨酸可以显著降低神经元胞体和树突的GPX4水平,但可以被STINGER、STING抑制剂和自噬抑制剂抑制,表明谷氨酸诱导的GPX4降低与STING介导的自噬有关。与此同时,谷氨酸增加神经元GSSG/GSH比例和ROS并降低总GSH水平,同样可以被STING抑制剂和自噬抑制剂所逆转。因此,STING介导GPX4的自噬降解可以扰乱神经元抗氧化反应,进而促进铁死亡的发生。和之前的猜测一致,cGAS缺失并不影响STING对神经元的作用。总之,STING并不以cGAS和IFN经典通路依赖的方式促进谷氨酸导致的铁死亡。
最后,作者在Stim1-cKO小鼠经EAE造模后观察到神经元GPX4低表达和LC3B高表达以及铁死亡,表明自噬依赖的铁死亡在STIM1敲除后加重。STING抑制剂则可以显著降低EAE造模引起的小鼠神经元损伤,升高GPX4水平、降低LC3B以及铁死亡,提示药物抑制STING改善神经元的炎性损伤。为了排除STING对小胶质细胞的影响,团队也使用神经元特异性STING敲除的小鼠,同样证实减弱的EAE疾病进展。
综上所述,这项研究发现STING通过整合干扰素和谷氨酸信号促进神经元的铁死亡,并为多发性硬化相关的神经退行性病变提供新的治疗靶标。
原文链接:https://doi.org/10.1016/j.cell.2024.05.031
