哺乳动物基因组的广泛转录产生大量非功能性新生转录本,产生R环和R环诱导的DNA断裂。然而,持续转录与R环形成爆发的耦合,给造血干细胞(HSCs)维持基因组完整性带来了挑战。
2025年12月6日,杭州师范大学汪虎、Wu Aiwei、上海市东方医院高亚威、暨南大学鞠振宇共同通讯在Cell Reports (IF=8.1)在线发表题为“Nuclear exosome targeting complex safeguards hematopoietic stem cell self-renewal and genomic integrity through resolving R loops”的研究论文。本研究展示了核外泌体靶向(NEXT)复合体,可将无功能新生转录本靶向转运至 RNA 外切体进行降解,在应对这一挑战的过程中发挥关键作用。
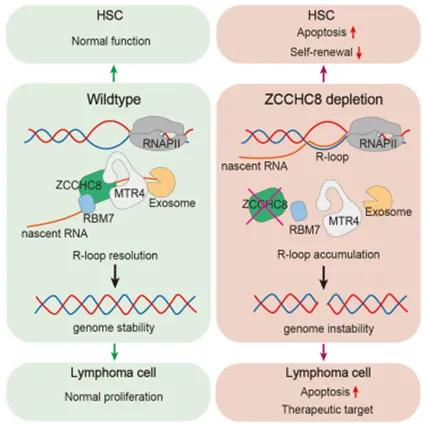
造血特异性缺失ZCCHC8(NEXT的核心亚基)不仅导致造血细胞自我更新受损,还因R环累积导致HSC中的DNA损伤升高和DNA修复通路上调。此外,ZCCHC8的失调在弥漫性大B细胞淋巴瘤(DLBCL)中较为常见,且与不良临床预后相关。总体来看,研究发现凸显了NEXT作为HSCs新型保护剂,并将其定位为DLBCL潜在的治疗靶点。
造血干细胞(HSCs)是骨髓(BM)中罕见的群体,通过自我更新和多谱系分化能力,产生所有类型的血细胞,并实现终身造血。为了确保其长期功能潜力,HSC必须保持其基因组完整性,否则可能导致HSC功能障碍甚至血液疾病。然而,这些长寿命细胞在其生命周期中会面临内在和外在的压力,对其基因组完整性构成诸多威胁。因此,推测HSCs必须具备独特的保护特性,以应对这些基因毒性压力并保障其基因组稳定性。然而,保护HSC基因组的因素尚未完全确定。
在稳态下,大多数HSC保持静止,以减少复制应激和活性氧对DNA的内在损伤。尽管造血干细胞进化出这种适应性机制,休眠状态下的造血干细胞其基因组完整性仍会受到转录等内源性细胞进程的威胁。哺乳动物基因组中高达90%的区域均可发生转录,产生大量新生RNA分子,其中大部分为无功能转录本。在转录过程中,新生RNA可与其模板DNA发生碱基配对,形成由RNA-DNA杂交链和一条置换单链DNA(ssDNA)构成的三链核酸结构,即R环。异常形成的R环能够激活转录偶联核苷酸切除修复(TC-NER)核酸内切酶机制,该机制会切割RNA-DNA杂交链,进而造成双链DNA断裂(DSB)或单链DNA断裂(SSB)。当这些静息期造血干细胞进入细胞周期后,R环介导的DNA损伤程度会进一步加剧。基于此研究认为,及时清除造血干细胞内的无功能新生RNA、阻止转录偶联R环形成,对维护其基因组完整性和再生潜能至关重要。
RNA外泌体是RNA代谢的核心角色,代谢通过降解缺陷、未处理或伪造的转录本,以维持转录组稳态。由于RNA外切体本身缺乏底物特异性,因此需要与RNA衔接蛋白复合物协同作用,才能精准靶向并降解各类RNA底物。核外切体靶向(NEXT)复合物是一种RNA外切体衔接蛋白,主要负责靶向降解无多聚腺苷酸(poly(A))尾的无功能转录本。该复合物包含三个核心亚基,分别是RNA解旋酶MTR4、RNA结合蛋白RBM7以及锌指蛋白ZCCHC8。其中,MTR4可直接与RNA外切体结合,通过解旋RNA底物并将其转运至RNA外切体核心区域完成降解;RBM7和ZCCHC8则通过识别RNA底物上游的基序实现底物特异性选择,并协助MTR4捕获底物。生物化学与结构生物学研究证据表明,NEXT复合物是清除无功能新生RNA的主要衔接蛋白,这提示其可能具有抑制转录偶联R环形成的作用。已有研究证实,敲除MTR4会导致小鼠和人类细胞中转录活跃的基因组区域出现R环大量累积。但目前尚不清楚转录偶联R环的清除是否由NEXT复合物独立介导。
NEXT在脊椎动物中高度保守,这表明其在生物体生理中起着关键作用。在人类人群中发现的ZCCHC8和RBM7突变与脊髓运动神经病变和智力障碍等神经系统疾病有关。此外,通过遗传连锁分析,已确定多种ZCCHC8功能丧失突变是家族性特发性肺纤维化的原因。值得注意的是,部分携带ZCCHC8突变的患者会出现血液疾病,表明NEXT在造血中的重要功能。然而,NEXT在造血系统中的生理作用尚未被报道。
图形摘要(摘自Cell Reports)
本研究借助ZCCHC8基因缺陷型人类细胞系和造血特异性ZCCHC8基因敲除小鼠模型,探究了NEXT复合物在清除R环方面的生化特性,并阐明了其在血液再生过程中的生理功能。研究发现,敲除ZCCHC8会导致人骨肉瘤细胞(U2OS)中R环异常累积,并伴随DNA损伤;而在小鼠体内,ZCCHC8缺失会造成造血干细胞自我更新能力受损,这一现象可能与细胞内R环大量累积以及R环诱导的DNA断裂密切相关。与此一致的是,ZCCHC8基因缺陷型造血干细胞中,DNA损伤应答及修复相关基因呈现广泛上调表达。此外,研究还发现,ZCCHC8表达水平升高的现象在弥漫性大B细胞淋巴瘤(DLBCL)中频发,且与患者不良临床预后密切相关。综上,本研究不仅证实了NEXT复合物在维护造血干细胞基因组完整性和长期功能方面的关键作用,同时也表明该复合物有望成为弥漫性大B细胞淋巴瘤治疗的潜在靶点。
原文链接:10.1016/j.celrep.2025.116650
