热休克蛋白90(Hsp90)是热休克蛋白家族中一组高度保守的分子蛋白,与客户蛋白和共伴侣相互作用以发挥作用。然而,它在胃癌中的作用机制尚不清楚。
2024年6月14日,中国医学科学院/北京协和医学院冉宇靓及首都医科大学舒雄共同通讯在Advanced Science 在线发表题为“Hsp90 Promotes Gastric Cancer Cell Metastasis and Stemness by Regulating the Regional Distribution of Glycolysis-Related Metabolic Enzymes in the Cytoplasm”的研究论文,该研究发现,胃癌组织中HSP90高表达,并且可与糖酵解协同作用影响胃癌的转移等恶性表型以及临床不良预后。同时,还强调了Hsp90和糖酵解作为联合治疗靶点的潜力。
在机制上,HSP90可以与PKM2、ENO1等糖酵解酶相互作用形成多酶复合物,提高糖酵解级联反应的效率实现高效供能。有趣的是,HSP90还可以与MYH9、ACTIN等细胞骨架相关蛋白结合,通过细胞骨架动力学调节糖酵解代谢酶在肿瘤细胞中的空间区域化分布,使其集中于细胞边缘及片状伪足等关键区域,实现精准供能,进一步促进肿瘤细胞发生EMT从而促进肿瘤的迁移侵袭和干性等恶性表型。因此,联合靶向HSP90、糖酵解和细胞骨架为治疗胃癌提供了一种潜在的治疗方案。
胃癌(Gastric Cancer,GC)作为世界发病率第五、死亡率第四的癌症。尽管手术、放化疗和免疫治疗取得了显著进展,但由于胃癌的驱动基因复杂性以及肿瘤的可塑性和肿瘤干细胞的存在,导致其总体生存率较差,易于复发和转移,目前仍缺乏有效的靶向治疗药物。代谢重编程已经在许多肿瘤类型中观察到,与肿瘤干细胞状态的维持、癌症进展和迁移以及耐药密切相关。其中糖酵解与EMT和干性在肿瘤中是高度交织的过程,然而,糖酵解在肿瘤细胞中的调控及其如何促进肿瘤发生EMT和转移仍是一个未解之谜,这对于研究肿瘤代谢和干性的特异性靶点及其抑制剂具有重要的临床意义。
HSP90作为伴侣分子,可以广泛参与细胞凋亡、蛋白质折叠和降解等基本细胞过程。既往的大多数研究主要集中在HSP90作为分子伴侣 调节致癌蛋白的构象、稳定性和功能,尤其是其在促进肿瘤进展中的详细机制。然而,最近的研究表明,HSP90的致癌形式可以与HSP70伴侣一起组成称为表伴侣组的高级复合物,这些复合物在活性构型中形成多种蛋白质复合物,比经典折叠伴侣复合物更为稳定。同时,通过限制功能相关酶的胞质区室化分布,形成功能性微区室,这些组装的“代谢体”可以提高代谢途径的效率,维持其生物量和营养利用的代谢优势。这些发现为HSP90形成多酶复合物,从而提高糖酵解效率并发挥促癌功能提供了理论支撑。
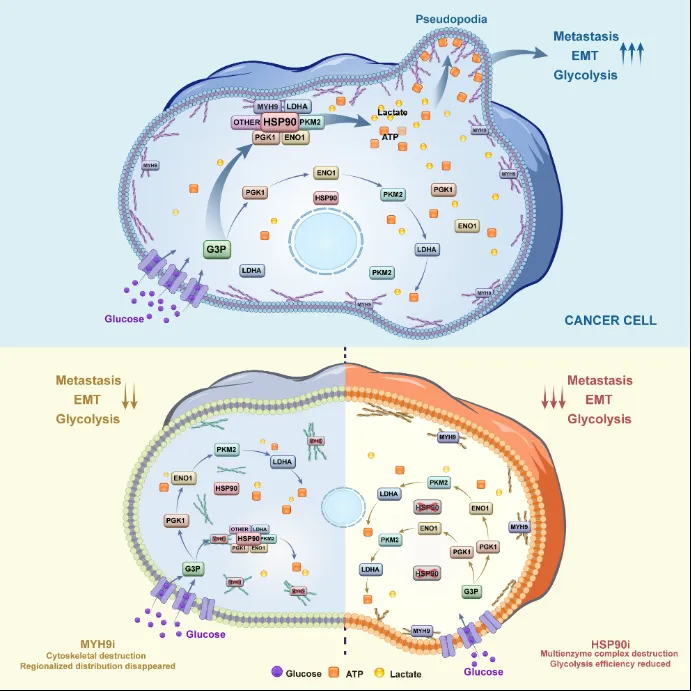
HSP90调控糖酵解促进胃癌进展的机制(图源自Advanced Science )
该研究发现并证明了HSP90可以作为肿瘤治疗的靶点,通过靶向调控癌细胞的干性特征与恶性表型。研究进一步探讨了了HSP90对肿瘤细胞糖代谢重编程的影响及其分子机制,首次证明HSP90可与糖酵解酶相互结合在,在细胞内调节糖酵解,促进肿瘤细胞干性和EMT。其机制涉及HSP90通过调控PKM2、ENO1糖酵解酶形成多酶复合物,并通过细胞骨架相关蛋白调控其在胞浆的区域化分布。这项研究能进一步证实,HSP90作为新的靶点,将为胃癌的治疗提供新思路。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202310109
