卵母细胞成熟对于配子发生和早期发育都是至关重要的,此时大量转录物产生而没有DNA复制。组蛋白变体可以以不依赖复制的方式整合到顺式调控元件中,自然适合这种调控。然而,它们在哺乳动物卵母细胞成熟过程中的作用仍不清楚。
2025年6月13日,清华大学颉伟、复旦大学张宇、重庆医科大学向云龙共同通讯在Nature Structural & Molecular Biology在线发表题为“H2A.Z is essential for oocyte maturation and fertility in female mouse”的研究论文,该研究表明H2A.Z卵母细胞特异性缺失,一种进化上保守的组蛋白变体,在雌性小鼠中导致深刻的表观遗传和转录改变,阻碍卵母细胞减数分裂II的恢复并导致不育。
从机理上来说,H2A.Z小鼠卵母细胞在活性启动子和推定的增强子处整合到染色质中。有意思的是,H2A.Z与生长中的卵母细胞、早期胚胎和小鼠胚胎干细胞不同,在完全生长的卵母细胞(FGOs)中,H2A.Z缺乏富含CG的沉默启动子,包括稳定的多梳靶基因。在FGOs中,H2A.Z的存在与组蛋白乙酰化相关,除了DNA甲基化和H3K36me3标记的区域。H2A.Z的损耗导致与缺陷基因表达相关的启动子和增强子亚群的活性受损。与基因激活的作用一致。FGOs中的H2A.Z在启动子和增强子处被广泛乙酰化。总之,该发现揭示了H2A.Z在哺乳动物卵母细胞成熟和女性生育力中的重要作用。
卵母细胞成熟对配子发生和早期胚胎发生至关重要。在这个过程中,卵母细胞经历了广泛的转录而没有DNA复制。在青春期,一部分卵原细胞发育成初级卵泡,最终成为FGOs。这些FGOs进一步从转录活性的非包围核仁(NSN)状态转变为沉默的包围核仁(SN)状态。然后,它们恢复减数分裂I,产生中期I (MI)卵母细胞,随后产生中期II (MII)卵母细胞。然而,对哺乳动物卵母细胞中转录调控回路和顺式调控元件(CREs)如启动子和增强子的了解仍处于初级阶段。
与典型组蛋白不同,与专门的伴侣蛋白和染色质重塑复合物配对的组蛋白变体可以以不依赖DNA复制的方式整合到染色质中。特别是,组蛋白变体经常被活跃地交换并整合到CREs来调节基因的激活或抑制。在小鼠卵母细胞中,敲除组蛋白变体H3.3的组蛋白伴侣Hira,导致DNA损伤增加和基因表达中断,导致不育。不同于其在CREs和异染色质上的典型定位,H3.3均匀分布在卵细胞的整个基因组中。尚不清楚这种非典型分布是否适用于其他组蛋白变体。此外,卵母细胞中的启动子和增强子(如果存在)是否仍然进行优先组蛋白变体交换,如果是,它们是如何被调节的,仍有待研究。
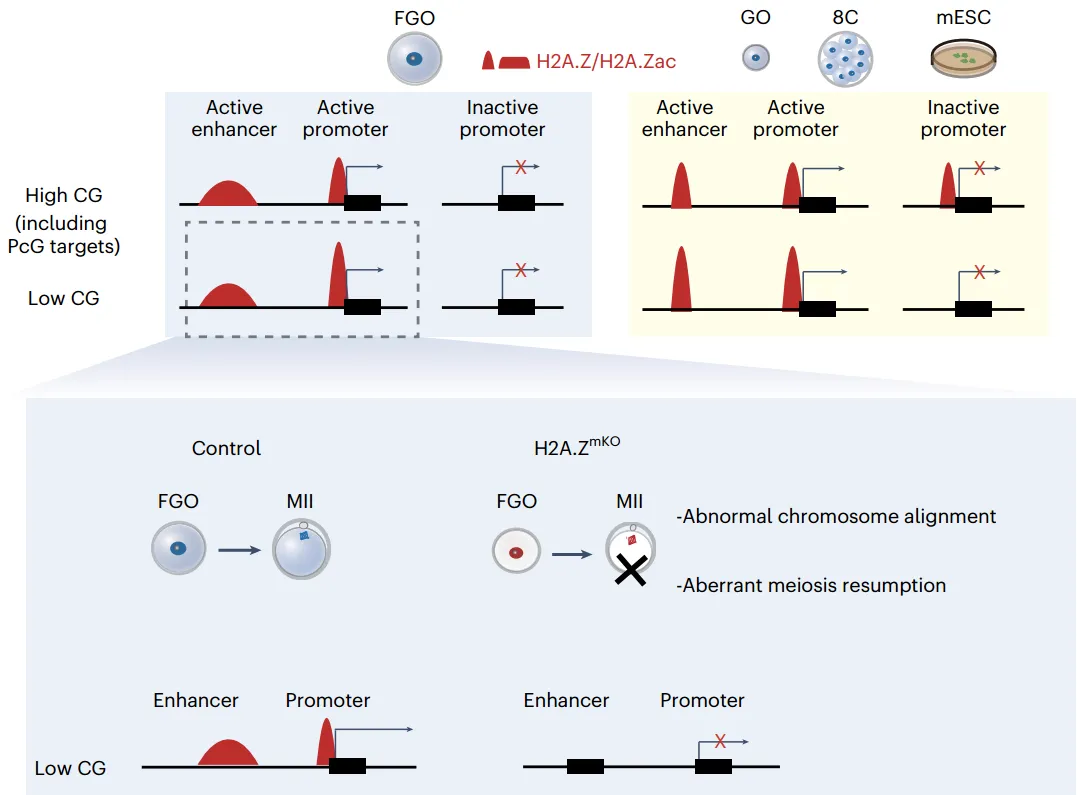
机理模式图(图源自Nature Structural & Molecular Biology )
H2A.Z,一种高度保守的组蛋白变体,是大多数生物体生存所必需的,通常富含启动子和增强子。H2A.Z参与维持开放染色质构象,促进转录因子(TF)结合和组装转录机器。例如,在小鼠胚胎干细胞中,H2A.Z通过启用密钥TFs的绑定来支持自我更新和区分。在哺乳动物中,H2A.Z活性启动子和增强子处主要由SRCAP和TIP60–P400复合物沉积。其成分MRG15和TIP60部分促进了这一过程,MRG15和TIP60识别H3K4甲基化,YEATS4(也称为GAS41)识别组蛋白乙酰化和琥珀酰化。在具有活性(H3在K4三甲基化(H3K4me3))和抑制性(H3K27me3)标记的二价启动子上,H2A.Z由SRCAP沉积并调节多梳和MLL复合物的结合。H2A.Z还被证明能促进染色质的致密化并刺激多梳的酶活性。
在这项研究中,研究人员建立了卵母细胞特异性双敲除H2az1和H2az2 (H2az1/2)的小鼠。H2A.Z是卵母细胞成熟和减数分裂恢复的关键。不像H3.3,H2A.Z主要定位于活性增强子和启动子,但在FGOs的稳定启动子中不存在。H2A.Z的去除导致FGOs中异常转录和CRE活性。最后,证明了H2A。z在CREs的卵母细胞中广泛乙酰化。这些发现首次系统揭示了组蛋白变体H2A.Z在雌性小鼠卵母细胞成熟过程中的核心调控功能,并进一步阐明其在维持顺式调控元件活性、塑造染色质状态及保障雌性小鼠生育力方面的重要机制。
参考信息:https://www.nature.com/articles/s41594-025-01580-y#Sec29
