染色体外DNA(ecDNA)是癌细胞中常见的一种致癌基因扩增形式,它们呈环状、大小可达兆碱基级别,但由于缺乏着丝粒,无法通过有丝分裂纺锤体正常分离至子细胞,而是随机分配。早在上世纪80年代,科学家就观察到ecDNA可通过“搭便车”的方式附着于有丝分裂染色体上进入子细胞核,从而在细胞世代间持续存在,然而这一过程背后的分子机制四十多年来始终未明。ecDNA的存在导致肿瘤细胞群体内致癌基因拷贝数出现异质性,并显著加速癌症的进化与适应性,但其无着丝粒的特性引出了一个核心科学问题——这些ecDNA是如何在细胞分裂过程中被有效地保留在子细胞核内的?此前研究发现,某些病毒附加体(如EB病毒)可通过特定的病毒DNA元件和蛋白介导其与宿主染色体的结合,以此实现核内保留。那么,人类ecDNA上是否可能也存在类似的、能够介导其与有丝分裂染色体结合的遗传元件,并成为ecDNA得以在快速增殖的癌细胞中实现“附加体永生”的关键呢?
近日,来自美国斯坦福大学的Howard Y. Chang团队在Nature上在线发表题为Genetic elements promote retention of extrachromosomal DNA in cancer cells的文章,开发了一种新型基因组规模功能分析方法——Retain-seq,并结合成像技术和染色质图谱分析手段,发现了一类人类基因组元件家族——将其命名为“保留元件(retention elements)”——能够将附加体锚定在有丝分裂染色体上,从而提升ecDNA向子细胞的传递效率,并阐明了保留元件促进ecDNA在分裂细胞中保留的作用原理。研究结果揭示了有丝分裂过程中ecDNA保留的DNA元件及其调控逻辑,证明保留元件的扩增促进了致癌ecDNA在癌细胞世代间的维持,并揭示了人类基因组固有的附加体永生性原则。
基于已有研究背景,本文研究人员首先提出理论模型,即ecDNA需依赖特定位点(本文称之为“保留元件”)锚定至染色体,从而在细胞分裂过程中实现"搭便车"式分配,而未锚定的DNA将因滞留细胞质而丢失。为验证该假说,研究团队开发了一种名为Retain-seq的新型基因组规模功能筛选方法,通过将包含随机人类基因组片段的质粒池转染至细胞并进行连续传代,然后对存留的质粒DNA进行测序分析,从而在全基因组范围内识别出能够显著富集、即具有“保留”功能的序列,并将这些序列定义为“保留元件”。研究证实,这些保留元件在多种细胞系中广泛存在,且单个保留元件的引入即可显著提升质粒在细胞内的持久性,其效果与已知的病毒附着序列相当,并且该过程并非通过促进质粒基因组整合实现,提示附加体保留元件在整个人类基因组中广泛分布。
随后,研究人员深入解析了保留元件的序列特征。研究发现,保留元件并非随机分布,而是高度富集于基因的转录起始位点、5'-UTR等活跃的染色质区域,并与H3K27ac、H3K4me3等活跃组蛋白标记以及BRD4、CTCF和SWI/SNF复合物等调控蛋白紧密结合,同时显著富含CpG序列且避免与异染色质标记或RNA聚合酶III重叠。功能实验证实,保留元件的活性具有累加效应但并非复制起点,且其功能不能简单地由通用的强启动子(如CMV启动子)所替代,表明其依赖于特定的序列背景和组合性的蛋白相互作用。这些结果表明,保留元件的本质是一类普遍存在于活性染色质区、具有累加效应和复合功能的特定DNA元件,其通过利用基因组固有的调控景观来促进ecDNA的保留。
进一步地实验结果显示,含有保留元件的质粒与有丝分裂染色体的共定位频率显著高于对照,表明单个保留元件即可将染色体“搭便车”的失败概率降低一半以上,从而直接证实了保留元件确实通过促进附加体与染色体的物理连接来增强其保留。此外,含有保留元件的异源质粒并不总是与内源性ecDNA共定位,说明其保留活性是自主的,不依赖于其他ecDNA。这些发现表明,保留元件发挥功能的核心机制在于在细胞分裂过程中,直接介导了附加体DNA与染色体之间的物理锚定。那么,癌细胞中含有致癌基因的ecDNA上的保留元件是否接触染色体上的特定位点呢?研究结果显示,在染色体高度凝缩的有丝分裂期,ecDNA上的保留元件仍能特异性地与染色体上被称为“有丝分裂书签”的、保持开放的基因组区域发生焦点性互作。这种ecDNA-染色体间的连接在分子层面上重现了增强子-启动子式的远程相互作用逻辑,即ecDNA上具有启动子特征的保留元件倾向于与染色体上的增强子样书签区域接触,而ecDNA上增强子样的保留元件则倾向于与染色体上的启动子样书签区域接触。此外,大量有丝分裂书签因子被发现富集结合于保留元件上,尽管单个因子的敲低并未导致ecDNA的广泛解离,表明该过程可能由多个冗余的蛋白因子协同介导。由此表明,ecDNA在癌细胞有丝分裂期的保留是通过其上的保留元件与染色体上有丝分裂书签区域发生特异性的、类似于染色质内调控元件的分子间相互作用来实现的。
最后,研究人员通过对癌症基因组图谱等公共数据库中大量患者肿瘤样本的全基因组测序数据进行分析,并结合进化模型模拟,系统性地探究了保留元件在人类癌症ecDNA中的存在与作用。研究发现,几乎所有致癌基因所在的ecDNA都共同扩增了保留元件,且ecDNA倾向于形成包含多个保留元件的超大扩增子,这显著提高了其在细胞分裂中的维持概率;相比之下,线性扩增子则大小不一且更常缺失保留元件。与此同时,研究人员还发现,即使存在强选择压力,ecDNA在每次分裂中的保留效率也必须高于90%才能被成功扩增和维持,这与单个保留元件所提供的保留效率相符。而基因组中保留元件的分布密度直接影响ecDNA扩增子的大小,在保留元件稀疏的区域,癌细胞倾向于选择更大的扩增子以增加捕获保留元件的机会。这些结果表明,保留元件与致癌基因在ecDNA上的共扩增并非偶然,而是癌细胞为确保持续拥有致癌基因优势所采取的关键进化策略,其存在直接塑造了癌症中ecDNA的结构与进化轨迹。值得一提的是,研究人员发现在癌细胞ecDNA上的保留元件普遍处于低甲基化状态,进一步实验则证实保留元件的功能依赖于其CpG位点的低甲基化状态,DNA甲基化通过抑制保留元件与染色质因子等细胞机器的相互作用,从而沉默其介导ecDNA保留的功能。
综上所述,本研究发现了一类新型的广泛存在的基因组元件——保留元件——能够促进ecDNA拷贝在分裂细胞中的保留,并阐明了其作用机制,提示这些基因组元件可能驱动了癌症中扩增子序列和结构的选择,从而影响DNA扩增的过程和癌细胞克隆的进化轨迹(图1)。对ecDNA保留机制的深入理解,或能为我们揭示不同癌细胞群体如何利用不同水平的致癌基因拷贝数变化,以及特定的ecDNA扩增子序列如何在肿瘤中被筛选出来提供见解。除此之外,本研究建立的这种DNA序列染色体外保留模型,也为理解人类细胞中DNA维持的最小功能单元提供了一个普适性框架,并可能指导用于细胞工程设计的合成DNA载体的构建。
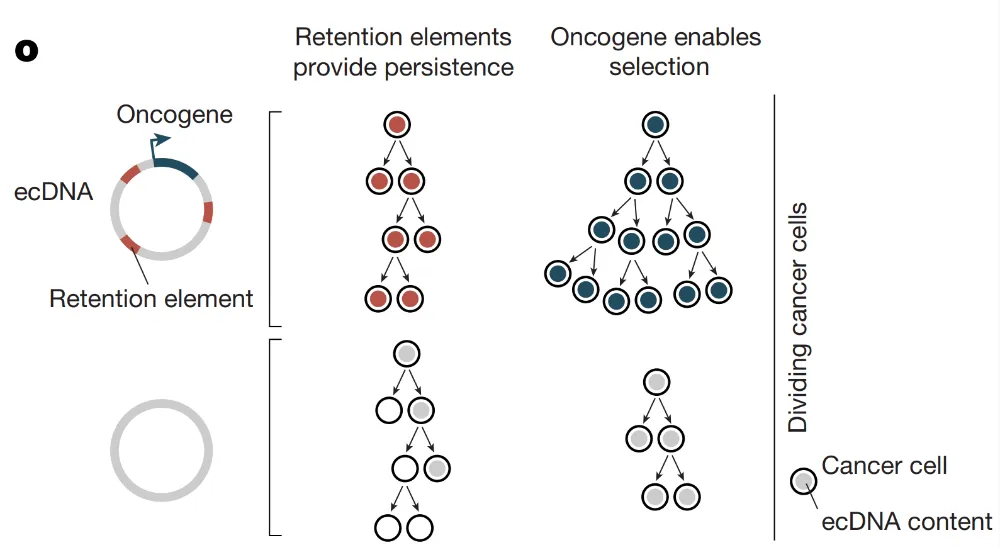
图1 位于ecDNA上的保留元件与致癌基因分别赋予了ecDNA保留能力和细胞选择优势,这两个过程共同塑造了癌细胞谱系的进化轨迹
原文链接:https://doi.org/10.1038/s41586-025-09764-8
