多梳蛋白(Polycomb group proteins)通过抑制基因表达对胚胎发育及细胞命运决定等过程起着重要作用,主要包含PRC1(Polycomb Repressive Complex 1),PRC2(Polycomb Repressive Complex 2)和PR-DUB(Polycomb Repressive Deubiquitinase)复合物。PR-DUB具有与PRC1相拮抗的酶活性,在核小体上特异性地去除组蛋白H2AK119的单泛素化修饰(H2AK119ub1);这一修饰在真核生物中普遍存在且含量丰富,在基因沉默及X染色体失活中发挥重要作用。人源PR-DUB复合物由泛素C端水解酶BAP1(BRCA1 associated protein 1)和多梳蛋白ASXL1/2/3(Additional Sex comb-Like)其中之一组成。BAP1单独没有酶活性,与ASXL蛋白的DEUBAD结构域结合后酶活性被激活。BAP1还是一个重要的肿瘤抑制因子,它与ASXL1在多种人类肿瘤中常发生高频突变。虽然果蝇PR-DUB复合物Calypso/ASX的晶体结构几年前得到了解析,由于缺乏与泛素化核小体底物的复合物结构,阻碍了人们对于其特异性去除核小体上H2AK119泛素化的分子机制的理解。
2023年3月29日,中国科学院生物物理研究所许瑞明课题组与朱冰课题组合作,在Nature在线发表了题为Basis of the H2AK119 specificity of the Polycomb repressive deubiquitinase的研究论文,报道了人源PR-DUB复合物结合H2AK119泛素化核小体的高分辨率电镜结构,揭示了PR-DUB特异性去除核小体H2AK119泛素化修饰的分子机理(图1)。
为了克服PR-DUB与核小体结合动态性较大的问题,研究团队探索样品制备条件,合成包含天然异肽键的K119泛素化H2A来组装核小体,加入了连接组蛋白H1以稳定核小体进出口DNA,并在酶活亚基BAP1上引入C91S失活突变来维持复合物的稳定性,最终解析了PR-DUB结合染色质小体3 Å分辨率的电镜结构。针对核小体在不同染色质区域的存在方式,也解析了与不含H1核小体的3.8 Å分辨率复合物结构。这两个结构高度相似,BAP1与ASXL1的DEUBAD结构域以异源二聚体的形式结合在核小体盘面上,H1以之前报道的on-dyad模式结合在进出口DNA处。
结构揭示BAP1富含正电荷的碳端尾巴(C-terminal extension, CTE)的699-706残基形成一个手指状结构,结合核小体内环DNA的对称轴(SHL0)附近,与DNA磷酸骨架,碱基基团以及组蛋白H3-H4直接相互作用。在BAP1的UCH催化结构域上,研究人员发现第56-60位的高度保守富含精氨酸序列(RRSRR)与核小体上的酸性区域相互作用,这种双位点结合模式将BAP1/ASXL1稳定地锚定在核小体盘面上。研究人员通过体外去泛素化酶活实验,验证了BAP1的CTE和56-60 RRSRR基序对BAP1去泛素化酶活性的重要性,并且在细胞水平利用RNA-seq方法分析了这些突变体对于基因表达的影响。ASXL1作为激活亚基与BAP1一起构成了完整的泛素结合位点。另外,两者的结合还帮助BAP1 CTE正确定位在核小体上。研究人员在ASXL1 DEUBAD结构域上设计了T262W和L267R这两个影响其与BAP1 C结合的点突变,并分别与BAP1形成复合物进行体外去泛素化酶活实验,发现在不突变BAP1的情况下,就可以破坏其酶活性,推断这两个突变通过影响BAP1 C的位置而影响了CTE与核小体的结合,表明ASXL1在BAP1的底物选择性中起到关键作用。研究还发现,结构中BAP1活性中心远离常规的H2AK119位点,泛素与BAP1/ASXL1结合,带着H2A C端尾巴向核小体盘面翘起,使连接H2A和泛素的异肽键靠近BAP1活性中心被水解。H2A C端尾巴巧妙的构象变化解释了BAP1的底物特异性选择机制,首次呈现了连接泛素与赖氨酸侧链的异肽键在组蛋白去泛素化酶活性中心的空间位置布局,拓展了人们对组蛋白H2A去泛素化过程的认知。
BAP1作为肿瘤抑制因子,在葡萄膜黑色素瘤(Uveal Melanoma)等恶性肿瘤中常发生高频突变,而ASXL1的移码及截短突变也经常发生在髓系白血病(AML)和Bohring-Opitz综合症中,且多为功能获得性(gain-of-function)的突变。为探究这些癌症相关突变与复合物酶活性的关联,研究人员在作用界面关键区域选取了与癌症相关的BAP1错义突变进行去泛素化酶活性分析,发现这些突变会造成BAP1酶活不同程度的下降。同时构建了含ASXL1 C端PHD结构域的融合蛋白,与BAP1形成复合物后,发现它们与不含C端结构域的复合物体外去泛素化活性并无明显差别,为理解细胞内ASXL1突变的作用机理提供了其它思路。
综上所述,该研究首次解析了组蛋白H2A去泛素化酶与泛素化核小体的高分辨率电镜结构,揭示了PR-DUB特异性去除H2AK119ub1的分子机制。相关的体外去泛素化酶活实验和细胞实验验证了PR-DUB与核小体相互作用界面的关键氨基酸的重要性,明确了激活亚基ASXL1在BAP1酶活调控中的重要作用,首次发现H2A C端尾巴特征性构象变化这一对H2AK119ub1特异性选择的结构基础。研究结果为深入理解BAP1和ASXL1突变在癌症发生发展中的作用机制以及相关的药物设计策略提供了重要的结构生物学基础。
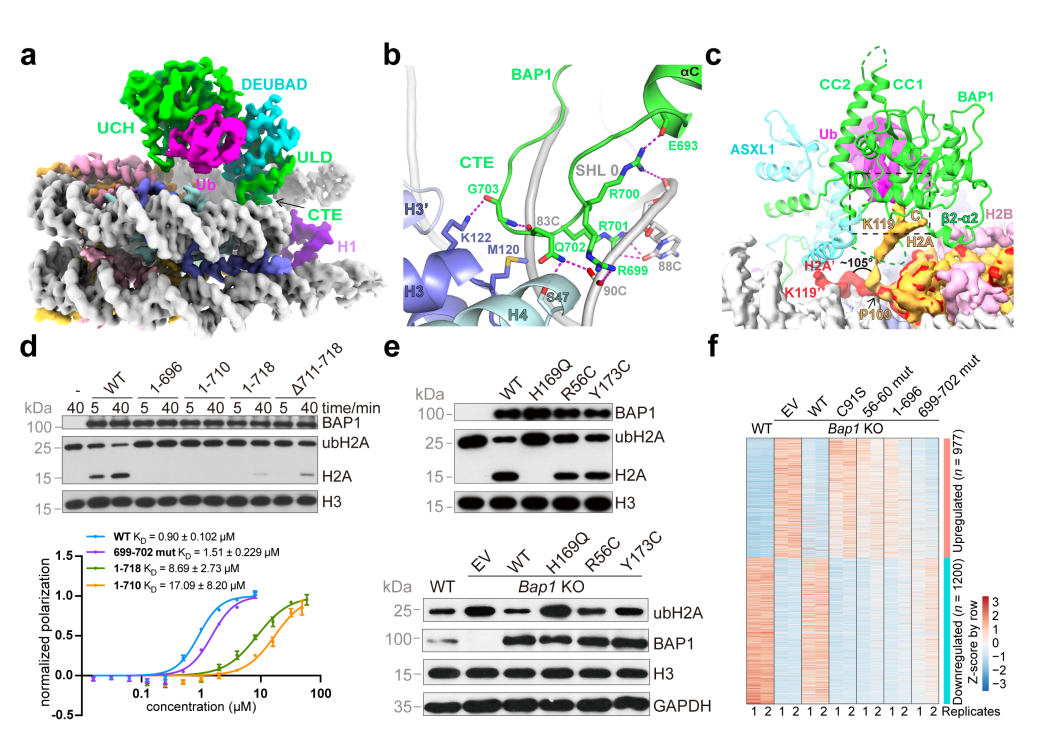
图1. PR-DUB与核小体复合物整体结构及功能实验分析
原文链接:https://doi.org/10.1038/s41586-023-05841-y
