同源重组(Homologous recombination,HR)是修复DNA双链断裂(Double-strand breaks,DSBs)的高保真途径,不仅在基因组稳定性维持中发挥重要作用,也与肿瘤发生发展和放化疗敏感性密切相关。HR利用同源序列进行修复,主要活跃在S-G2期。HR反应从DNA末端加工开始,产生3’端裸露的单链DNA(ssDNA)。复制蛋白A(Replication protein A,RPA)复合体(RPA1,RPA2以及RPA3)迅速包裹ssDNA,然后被重组因子RAD51取代。因为RPA对ssDNA的亲和力比RAD51更高,所以RAD51在ssDNA上的组装需要一系列调控蛋白介导。其中,BRCA2是RAD51-ssDNA生成的最经典调节因子;此外,组蛋白伴侣分子ASF1和CAF1可以依赖MMS22L-TONSL复合物调节RAD51-ssDNA的形成;TOPBP1(DNA Topoisomerase II Binding Protein 1)可通过促进PLK1激酶介导的RAD51磷酸化,帮助RAD51结合ssDNA。这些研究表明细胞中存在多种独立或相互联系的机制调控RAD51核丝组装。RPA-ssDNA作为HR过程中DNA损伤修复蛋白质机器招募和解离的重要平台,在以往研究中备受关注。然而,是否存在可将RPA沉积和RAD51核丝生成联系起来的中间调控事件,仍需要进一步探究。
2022年5月20日,天津医科大学石磊课题组和张锴课题组在Molecular Cell杂志上合作发表了题为A PARylation-phosphorylation cascade promotes TOPBP1 loading and RPA-RAD51 exchange in homologous recombination的研究成果。该研究探索了多聚 (ADP-核糖) 化和磷酸化级联反应调节同源重组过程中TOPBP1沉积和RPA-RAD51交换的分子机理。
TOPBP1含有多组成对出现的BRCT(BRCA1 C-terminal)结构域,它们负责识别不同磷酸化形式的配体蛋白,决定了TOPBP1在复制起始或复制压力应答中的特异性工作模式。然而,在HR倾向性的DSBs染色质区域,TOPBP1是如何被募集的尚不清楚。作者发现HTATSF1(HIV Tat-specific factor 1)在复制活跃细胞中高表达,是S期TOPBP1相互作用蛋白;HTATSF1 C端S748位点以CK2激酶依赖的磷酸化形式与TOPBP1 BRCT 0-2结构域结合,BRCT 0-2的K250位点负责阅读S748磷酸化修饰。以往研究表明,K250位点也是TOPBP1识别DDR(DNA damage response)分子53BP1和MDC1的关键氨基酸残基。与之不同的是,HTATSF1主要控制S期TOPBP1在损伤染色质上的募集。此外,该事件并不依赖HTATSF1的RNA结合或加工活性。作者进一步研究发现HTATSF1利用N端RRMs(RNA recognition motif)识别多聚(ADP-核糖)化的RPA,借此将HTATSF1-TOPBP1复合体直接招募到RPA-ssDNA平台,进而促进RAD51核丝生成和RPA解离。
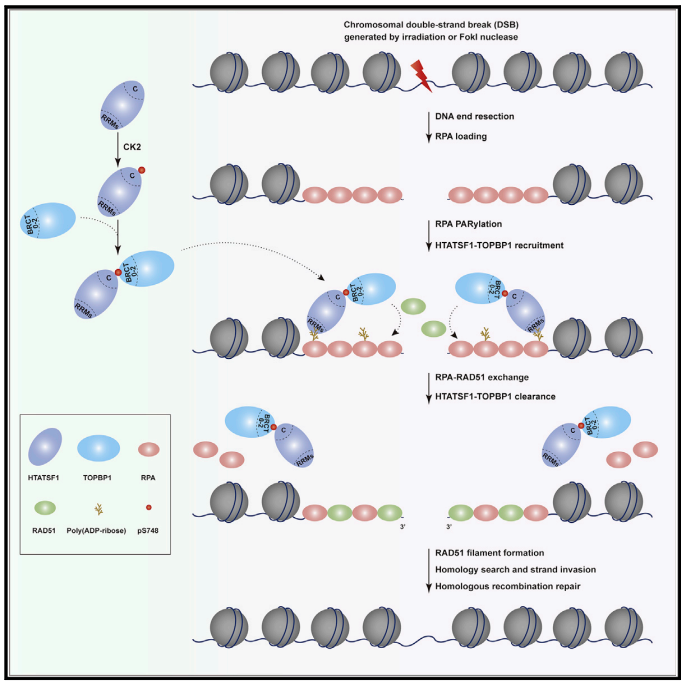
该研究工作模型
综上,该研究揭示了多聚(ADP-核糖)化和磷酸化级联反应调控TOPBP1在HR倾向性损伤染色质募集以及RPA-RAD51交换中的重要作用,发现了PARP1在HR修复中的新功能,提示TOPBP1 BRCT 0-2磷酸化配体蛋白结合口袋可能成为潜在的肿瘤治疗靶点。
