铁死亡是一种细胞死亡方式,其中铁依赖性脂质过氧化物积聚在细胞膜上。半胱氨酸是谷胱甘肽系统的一种限制性底物,可中和脂质过氧化并防止铁死亡,可通过胱氨酸还原转化或由甲硫氨酸合成。然而,越来越多的证据表明,基于蛋氨酸的半胱氨酸合成不能有效地恢复半胱氨酸剥夺后的细胞内半胱氨酸水平,也不能抑制铁死亡。
2024年10月17日,东北师范大学王杨、魏民、巴雪青共同通讯在Nature Communications 在线发表题为“Methionine-SAM metabolism-dependent ubiquinone synthesis is crucial for ROS accumulation in ferroptosis induction”的研究论文,该研究拓宽了对氨基酸代谢与铁死亡调节的交叉关系的认识,提供了对其潜在机制的深入了解,并提示甲硫氨酸-SAM轴是治疗铁死亡相关疾病的一种有前景的治疗策略。
研究阐述了基于甲硫氨酸的半胱氨酸合成是组织特异性的。出乎意料的是,研究发现甲硫氨酸并没有抑制铁死亡,而是在胱氨酸剥夺诱导的铁死亡中发挥了重要作用。甲硫氨酸衍生的S-腺苷蛋氨酸(SAM)有助于甲基化依赖性泛醌合成,导致脂质过氧化物积累和随后的铁死亡。此外,在肿瘤生长抑制小鼠模型中,补充SAM与咪唑酮Erastin具有协同作用。抑制将甲硫氨酸转化为SAM的酶可以保护心脏组织免受阿霉素诱导和铁死亡引起的心肌病。
铁死亡是一种新发现的由铁依赖性脂质过氧化引起的受调控的细胞死亡,在形态、生化和遗传上不同于其他形式的细胞死亡,包括凋亡、坏死和自噬。虽然铁死亡的生理功能尚不清楚,但已确定其参与几种病理条件。铁死亡是与缺血性器官损伤相关的细胞死亡的主要原因,如缺血性心肌病和肾衰竭。新出现的证据表明,铁死亡存在于与神经系统疾病相关的神经元细胞死亡中,包括阿尔茨海默病、帕金森病和亨廷顿病。此外,铁死亡诱导在临床治疗中具有很大的抑瘤潜力。
脂质过氧化是导致铁死亡的直接原因。为了对抗脂质过氧化,谷胱甘肽过氧化物酶4 (GPX4),一种磷脂氢过氧化物酶,利用谷胱甘肽(GSH)作为不可或缺的催化辅助因子,将磷脂氢过氧化物还原为相应的磷脂醇。GPX4/GSH被认为是预防铁死亡的主要系统,它可以有效地减少细胞膜上积累的脂质过氧化物。越来越多的证据表明,许多类型的癌细胞对GPX4失活或GSH耗竭引起的铁死亡敏感。谷胱甘肽是由半胱氨酸、谷氨酸和甘氨酸组成的三肽,由ATP依赖性酶谷氨酸-半胱氨酸连接酶和谷胱甘肽合成酶分两步合成。对于谷胱甘肽的生成,含硫半胱氨酸是限速前体。因此,铁死亡是一种非常独特的细胞死亡类型,它不仅受脂质代谢和铁代谢的调节,还受氨基酸代谢的调节。
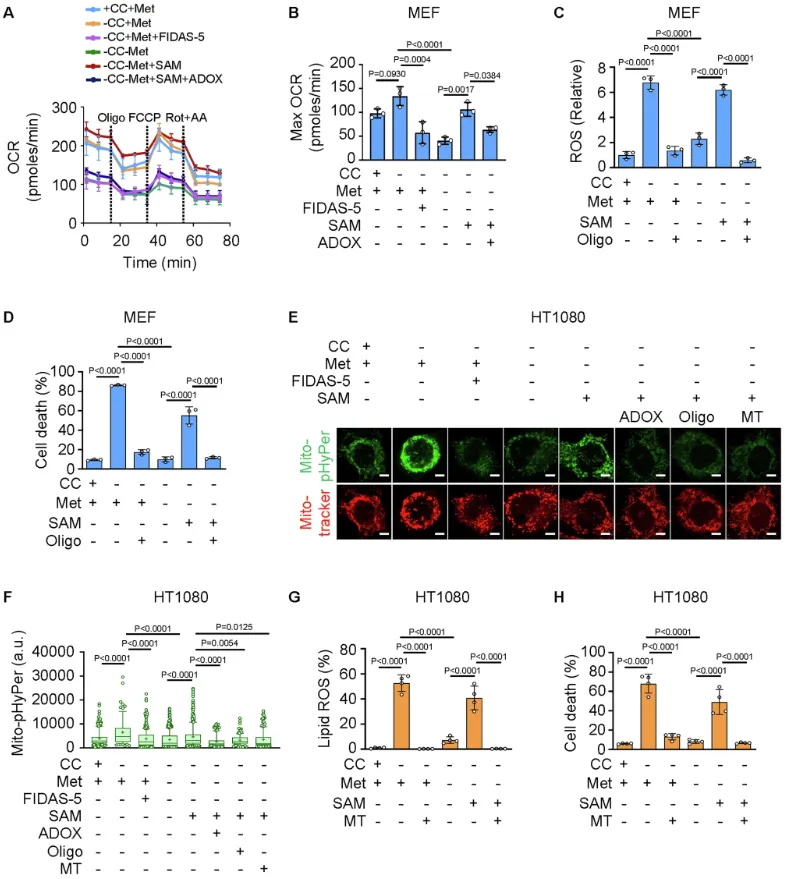
线粒体氧磷基ROS在甲硫氨酸-SAM轴下游的积累是导致铁死亡的原因(图源自Nature Communications )
细胞内半胱氨酸主要由胱氨酸还原转化,通过溶质载体家族7成员11 (SLC7A11,也称为xCT)转运到细胞内。xCT是一种氨基酸反转运蛋白,介导细胞外胱氨酸和细胞内谷氨酸的跨膜交换。半胱氨酸除了可以由外源获得的胱氨酸转化外,还可以由另一种含硫氨基酸甲硫氨酸转化。甲硫氨酸是一种必需氨基酸,通过转硫途径参与细胞半胱氨酸的合成。然而,大量研究表明,仅通过Erastin或IKE等xCT抑制剂消耗细胞外胱氨酸或抑制胱氨酸摄取,就足以导致细胞内半胱氨酸和GSH池的消耗,从而导致GPX4失活和过氧化磷脂积累,从而诱导铁死亡。这暗示以甲硫氨酸为基础的内源性半胱氨酸合成途径不能有效地挽救细胞内半胱氨酸水平,不能预防铁死亡。问题是,在研究中使用的测试细胞中,转硫途径是否被破坏,或者生产能力有限。
研究明确了转硫途径的组织特异性。研究发现,甲硫氨酸不仅没有明显的抑制作用,相反,甲硫氨酸对胱氨酸剥夺诱导的铁死亡是必需的。从机制上讲,甲硫氨酸衍生的s -腺苷蛋氨酸(SAM)被利用合成泛醌,并且是ROS释放所必需的,ROS释放是胱氨酸剥夺诱导的脂质过氧化的原因。因此,补充SAM可与IKE协同抑制肿瘤生长;抑制将甲硫氨酸转化为SAM的甲硫氨酸腺苷转移酶2A (MAT2A)可以保护心脏组织免受多柔比星(DOX)诱导和死铁驱动的心肌病的影响。
参考消息:https://www.nature.com/articles/s41467-024-53380-5
