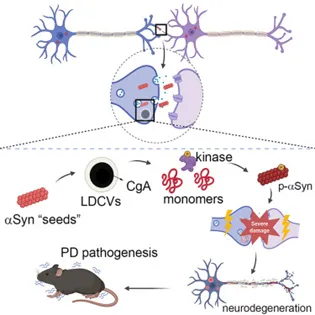
α-突触核蛋白(αSyn)聚集是帕金森病(PD)的一个显著特征,但其初始细胞机制尚不清楚。2025年11月15日,同济大学吴齐辉及郑加麟共同通讯在Cell Reports(IF=8.1)在线发表题为“Chromogranin A promotes the pathological conversion of α-synuclein at the synapse in Parkinson’s disease”的研究论文。本研究发现,单次给予αSyn预制原纤维(PFF)后,磷酸化αSyn(p-αSyn)在原代神经元的突触前膜显著定位。嗜铬粒蛋白A(CgA)存在于大致密核心囊泡(LDCVs)中,在多种神经元模型及PD小鼠模型中过表达CgA,可增强αSyn的聚集。随后,通过将αSyn与CgA共同孵育,我们构建了一种独特的原纤维菌株——与传统αSyn原纤维相比,该菌株长度更短、抗蛋白水解消化能力更强、淀粉样变性特性更显著。此外,CgA敲除可减轻αSynPFF诱导的树突棘丢失和突触功能障碍,并在体内减缓病理性包涵体的扩散。综上,本研究证实囊泡内基质蛋白CgA可触发并促进αSyn病理相关的早期种子形成事件,进而引发后续的毒性效应。
α- 突触核蛋白(αSyn)异常聚集是帕金森病(PD)、路易体痴呆(DLB)及其他突触核蛋白病的特征性组织病理标志。尽管目前研究已取得显著进展,但在PD 早期阶段,αSyn 包涵体形成与扩散的细胞机制仍不明确,亟需进一步研究。在中枢神经系统中,神经元活动对于通过突触传递维持细胞功能至关重要。突触结构和功能通常在神经元退行性丧失前就已受损,而异常神经元活动则破坏致病蛋白释放与清除之间的平衡,从而加速多巴胺能神经元退化和PD进展。嗜铬粒蛋白A(CgA)是一种囊泡内基质蛋白,负责将单胺类神经递质富集到致密核心囊泡中,以维持高效的突触传递。作为主要定位于大致密核心囊泡(LDCVs)的酸性单体蛋白,CgA由神经内分泌细胞分泌。中枢神经系统神经元含有大量大致密核心囊泡,其数量因神经突起长度而异。此前,研究者及合作者的研究表明,CgA敲除(KO)可显著减少“量子化”儿茶酚胺释放,但不影响ATP 释放。
图形摘要(摘自Cell Reports)
鉴于CgA及其衍生肽的多样生理功能,研究推测这种颗粒蛋白可能在多种神经疾病的进展中发挥致病作用。具体而言,在阿尔茨海默病(AD)患者中,有研究报道高度活化的小胶质细胞围绕CgA阳性斑块的频率显著高于β淀粉样蛋白(Aβ)阳性斑块。近期一项研究发现,CgA敲除可减轻tau蛋白病。此外,CgA异常表达与多种路易体相关神经退行性疾病密切相关,且已被用作区分AD与路易体痴呆(DLB)的生物标志物。更重要的是,蓝斑核神经元中存在CgA与路易体的共聚集现象,且细胞内聚集程度与DLB的Braak分期呈正相关,这表明CgA与路易体形成之间存在密切关联。本研究系统探讨了CgA在突触前膜αSyn病理聚集与扩散中的病理生理作用。研究提出假设:定位于大致密核心囊泡(LDCVs)的CgA可能显著启动并加速αSyn的致病过程。
原文链接:10.1016/j.celrep.2025.116562
