肥胖是一种常见的合并症,影响接受手术或免疫疗法患者的治疗。越来越多的证据表明,肥胖者的免疫系统严重失调会导致机体处于低度炎症状态。在瘦状态的稳态条件下,2型先天淋巴样细胞(ILC2)、嗜酸性粒细胞、抗炎巨噬细胞、调节性T细胞(Tregs)和CD4+ T辅助2(TH2)细胞填充脂肪组织。在进展为肥胖的过程中,脂肪组织中炎症细胞的组成会发生变化,其特征是1型先天淋巴样细胞(ILC1)、中性粒细胞、M1巨噬细胞、CD8+ T细胞、TH1细胞和TH17细胞。虽然已知免疫调节在脂肪组织稳态中起重要作用,但是人们对脂肪组织稳态失调和促进肥胖发展的免疫事件仍不完全了解。
近期,德国埃尔朗根-纽伦堡大学Christian Schwartz在Science translational medicine期刊上发表题为 Innate PD-L1 limits T cell–mediated adipose tissue inflammation and ameliorates diet-induced obesity 的文章,使用转基因小鼠在饮食诱导的肥胖模型和肥胖患者的样本中研究了PD-L1在肥胖期间的细胞特异性作用,表明树突状细胞(DCs)上的PD-L1控制脂肪组织内的适应性免疫反应,以限制饮食引起的肥胖。
首先,作者在高脂饮食(HFD)诱导的肥胖模型中比较了野生型(WT)和PD-L1-/-小鼠的肥胖过程,来分析PD-L1的表达是否直接影响肥胖发展。结果观察到PD-L1-/-小鼠在HFD 12周后体重显著增加,反映在更大的附睾白色脂肪组织沉积物,初步证明了PD-L1可以延缓肥胖的发生。
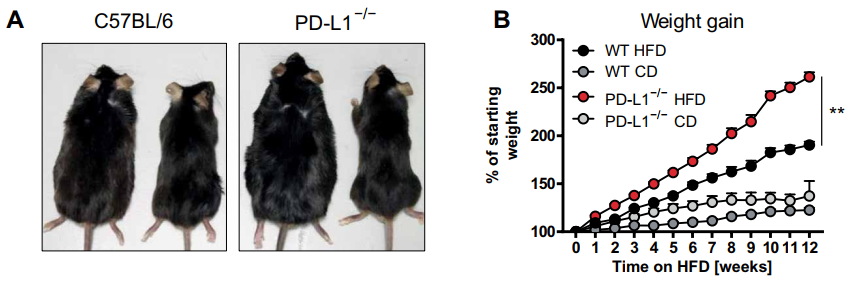
图1 PD-L1延缓高脂饮食诱导的肥胖
对 Rag1-/- 小鼠(缺乏T和B淋巴细胞)和 Rag2-/- Il2rg-/- 小鼠(缺乏淋巴细胞、NK细胞和ILC)的分析表明,饮食诱导期间体重增加,当适应性免疫细胞缺失时,肥胖会减少,在先天免疫和适应性免疫缺失的情况下更为明显,说明先天免疫和适应性免疫在肥胖发展中发挥重要的作用。进一步,从肥胖动物的脂肪组织中分离的DC、巨噬细胞、CD4+ T细胞和ILC2上PD-L1的表达增加,PD-L1缺乏会损害脂肪组织T细胞极化,表明PD-L1在饮食诱导的肥胖期间脂肪组织内适应性免疫反应的调节中起重要作用。
接下来,作者分析了PD-L1在HFD诱导的肥胖过程中的细胞特异性功能,发现ILC、T细胞和巨噬细胞的PD-L1表达对于脂肪组织的稳态或炎症不是必需的,而脂肪组织中的DCs上PD-L1表达升高,DCs上的PD-L1通过PD-L1:PD-1在DCs和T细胞以及DCs和ILC2s之间发生相互作用,促进2型免疫反应,同时抑制TH1增殖,从而限制脂肪组织炎症和肥胖的发展。
进一步,作者分析PD-L1与人类肥胖是否相关。发现在人类肥胖者的脂肪组织中PD-L1表达显著增加,促炎细胞因子TNFα表达显著升高,在内脏而非皮下脂肪组织中的相对PD-L1表达与BMI之间存在正相关。PD-L1在先天和适应性细胞群中上调,包括CD4+ T 细胞(P = 0.203)和巨噬细胞(P = 0.057)适度升高,cDC1s(P = 0.013)和ILC2s(P = 0.028)显著增加。
最后,作者研究了PD-L1等免疫检查点疗法是否会在肥胖期间干扰脂肪组织免疫细胞,发现PD-L1 mAb治疗不仅会导致HFD小鼠的葡萄糖耐量显著降低,导致更差的代谢状态,还会导致体重的增加,表明免疫检查点抑制剂治疗会影响脂肪组织稳态和代谢健康。
总而言之,树突状细胞(DC)的PD-L1缺失会增加饮食诱导肥胖期间的体重增加和代谢综合征。DCs通过PD-L1:PD-1轴与T细胞和ILC2s相互作用,分别抑制TH1细胞增殖和促进TH2细胞极化。肥胖人群内脏脂肪中PD-L1的表达与体重升高呈正相关。作者定义了一种由DCs表达PD-L1控制的脂肪组织稳态机制,这可能是免疫检查点抑制剂治疗期间免疫相关不良事件的临床相关发现。
顺便提及一句,2020年发表在JITC上的一篇文章已经报道了在脂肪细胞中敲除PD-L1会导致肥胖。
