脓毒症是一种由微生物感染引起的常见病理综合征,与重症监护病房的高死亡率密切相关。2017 年的全球数据显示,脓毒症每年导致全球约 20% 的死亡,因此世界卫生组织呼吁加快研究以改善其诊断和治疗 。脓毒症的临床过程从早期炎症阶段发展到晚期免疫抑制阶段,这一过程由病原体相关模式分子 (PAMP) 启动。住院患者脓毒症的主要原因是革兰氏阴性菌感染,会释放细胞壁成分脂多糖 (LPS) 激活免疫通路。先天免疫系统是抵御入侵病原体的第一道防线,但是其过度激活会导致细胞因子风暴、多器官功能障碍,甚至死亡 。尽管免疫代谢紊乱是脓毒症特征性病理改变,但其关键致病分子尚不清楚。
2022年8月来自美国西南医学中心的RUI KANG、DAOLIN TANG和中国创伤、烧伤与复合伤国家重点实验室蒋建新团队在Science Translational Medicine杂志上发表了一篇题为Aconitate decarboxylase 1 is a mediator of polymicrobial sepsis的论文,报道了乌头酸脱羧酶 1 (ACOD1)是一种脓毒症关键致死介质。
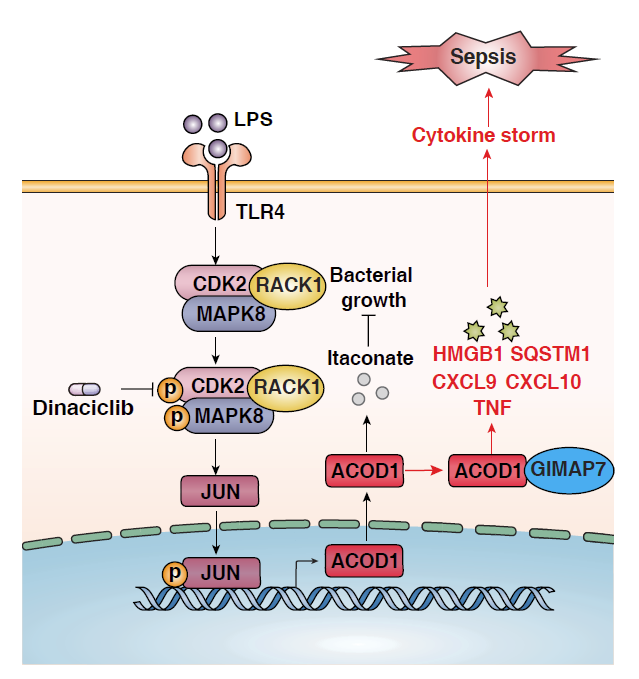
乌头酸脱羧酶 1 (ACOD1),也称为IRG1,是一种线粒体酶,最初被鉴定为由 LPS 在小鼠巨噬细胞中高度诱导的基因。ACOD1 通过产生衣康酸(一种竞争性抑制琥珀酸脱氢酶以调节三羧酸循环的代谢物)在协调髓样细胞的免疫代谢中发挥功能。内源性衣康酸盐还可以通过 KEAP1的烷基化激活NRF2介导抗炎反应,限制核因子 IκBζ - 依赖性促炎细胞因子产生,或抑制炎性小体信号通路活化。尽管 ACOD1 依赖性衣康酸产生在疾病中的作用众所周知,但独立于衣康酸的 ACOD1 的调节和功能仍然缺乏。
在这项研究中,作者通过药物筛查结合基因干预手段报道细胞周期蛋白依赖性激酶 2 (CDK2) 能够通过激活转录因子 JUN 来调节单核细胞和巨噬细胞中 ACOD1的表达。下一代测序显示 ACOD1 通过激活多种免疫途径介导促炎反应。ACOD1 是维持促炎性肿瘤坏死因子 (TNF) 信号传导所必需的,主要以衣康酸非依赖性方式发生。通过药物或者基因手段阻断 CDK2-ACOD1 轴可减轻小鼠脓毒症死亡发生。确认人类脓毒症中 CDK2-ACOD1 轴的上调进一步表明,在脓毒症中靶向该途径可以改善结果。
总之,作者报告了一项针对 CDK2 依赖性 ACOD1 表达以预防细菌性脓毒症的概念验证研究。临床前结果证明了 dinaciclib 给药作为多种形式脓毒症的干预措施的有效性,并提出了针对脓毒症修改抗癌药物(如 dinaciclib)的治疗原理。