缺血性脑卒中后肠通透性显著增加,部分原因是粘膜屏障被破坏,但其机制尚不清楚。
2024年10月8日,南方医科大学何彦、尹恝、徐开宇共同通讯在Cell Reports Medicine在线发表题为“Activated sympathetic nerve post stroke downregulates Toll-like receptor 5 and disrupts the gut mucosal barrier”的研究论文,该研究揭示了交感神经破坏粘膜屏障的神经通路,为脑卒中损伤提供了潜在的治疗靶点。
研究发现粘液破坏开始于中风后2小时,而杯状细胞功能保持完整。与此同时,鞭毛细菌幽门螺杆菌繁殖并渗透到黏液层。在无菌小鼠中消除粘膜微生物群或移植幽门螺杆菌,揭示了粘膜微生物群在粘液破坏中的重要作用。细菌入侵是由于toll样受体5 (TLR5)及其下游产物鞭毛蛋白特异性IgA和抗菌肽的下调。敲除肠道TLR5可增加鞭毛菌的丰度,加重黏液损伤。肠道TLR5因交感神经的激活而下调。脑卒中患者血清去甲肾上腺素水平与鞭毛蛋白水平及预后呈正相关。
中风是全球第二大死亡和残疾原因。中风患者的绝对数量,包括死亡或残疾患者,在过去30年里翻了一番。预计从2020年到2050年,脑卒中死亡率将继续增加50%,残疾调整生命年将增加31%,给家庭和社会带来巨大负担。缺血性中风约占中风总数的87%,是目前神经病学研究的主要焦点之一。再通是缺血性脑卒中的主要治疗策略,此外还有神经保护治疗。然而,几乎所有这些试图保护缺血性半暗带的神经保护疗法在临床试验中都失败了。因此,研究人员正在寻找大脑以外的外周器官的替代治疗靶点。
其中一个重要的研究方向是观察肠道,因为越来越多的证据表明,中风增加了肠道通透性,从而促进了肠道有毒内容物转运到体循环中,从而加剧了中风损伤。之前的研究也表明,中风诱导肠道硝酸盐的过量产生,促进肠杆菌的生长,从而通过脂多糖(LPS)从肠道转运到血液中加速全身炎症,进一步加重脑梗死。这些研究强调了肠道屏障在中风损伤中的重要性,但中风后肠道屏障是如何被破坏的仍然是难以捉摸的。
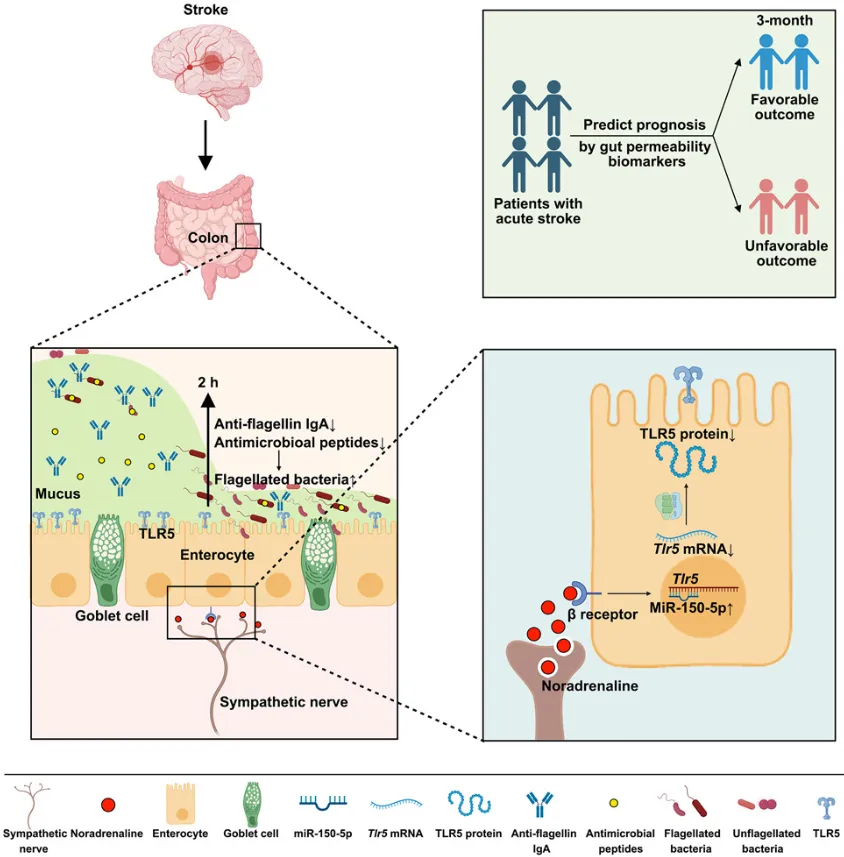
图形摘要(图源自Cell Reports Medicine )
肠内的物理屏障包括两部分,即由紧密连接连接的上皮屏障,包括闭塞带(ZO)、闭塞蛋白和闭合蛋白,以及由黏液层形成的粘膜屏障,其主要功能是防止管腔成分渗透到下层肠组织中。黏液层是上皮细胞分泌的蛋白质的储存库,如分泌性免疫球蛋白A和抗菌肽。因此,黏液层是宿主抵御病原体入侵的第一道防线。然而,在以往的中风研究中,大多数关注的是肠道紧密连接,而粘液屏障却被忽视了。由于黏液蛋白是由杯状细胞生物合成的,因此将黏液屏障与杯状细胞联系起来是很自然的。事实上,在中风后72小时观察到杯状细胞数量减少。然而,除了杯状细胞功能障碍外,关于中风期间黏液层动态变化和黏液层受损机制的研究仍然很少。
研究发现,从中风后2小时开始,黏液层的厚度明显减少,但杯状细胞同时保持完整,这为黏液层的破坏提供了另一种解释。同时,感知细菌鞭毛的Toll样受体5 (TLR5)的表达在中风后显著下调,提示粘膜微生物群可能参与了粘液破坏。进一步揭示了交感神经介导的肠道TLR5下调,导致鞭毛蛋白特异性IgA和抗菌物质的产生减少,从而促进鞭毛细菌的入侵和黏液层的破坏。研究可能为靶向交感神经系统保护肠道屏障和脑卒中损伤提供治疗潜力。
参考消息:https://www.sciencedirect.com/science/article/pii/S2666379124004841
