胶质母细胞瘤是最具侵袭性且目前无法治愈的原发性脑肿瘤,具有影响巨噬细胞极化的独特代谢特征。已知胶质母细胞瘤肿瘤微环境(TME)中最丰富的巨噬细胞对该瘤的发生和治疗反应均有显著影响,因而被试作治疗靶标,但瘤内及患者间的高度异质性使靶向泛巨噬细胞的“一刀切”策略难有明显成效。
近日,来自荷兰癌症研究所的Leila Akkar团队在Cell杂志上发表了一篇题为Macrophage-mediated myelin recycling fuels brain cancer malignancy的文章,他们利用单细胞和多组学分析探究了胶质母细胞瘤TME中肿瘤相关巨噬细胞(TAM)的异质性,并揭示了它们与不同胶质母细胞瘤亚型的特定相互作用,为开发胶质母细胞瘤亚型特异性的治疗策略提供了重要信息。
该团队利用两个能模拟人类胶质母细胞瘤关键特征的小鼠模型来研究肿瘤细胞和巨噬细胞的异质性,并验证治疗前和放疗后复发过程中是否发生亚型转变。结果显示星形胶质细胞样(AC)原发肿瘤在复发时会向少突胶质祖细胞样(OPC)转变,而OPC样则在复发时向间充质样(MES)转变,与此同时,TME中的巨噬细胞包括小胶质细胞(MG)和单核细胞源性巨噬细胞(MDM)可各自划分为4个子集,其动态与胶质母细胞瘤阶段及亚型组成相关,比如MG3-GPNMB、MDM3-GPNMB子集在MES样复发性肿瘤中显著增加,而这类GPNMBhigh TAM表现出载脂巨噬细胞(lipid-laden macrophages, LLM)的特征(富含脂质、脂质受体CD36表达上调、炎症通路相关基因下调、免疫抑制表型如PD-L1表达增加等)。脂质组学分析显示这群LLMs中胆固醇、胆固醇前体和三酰甘油等水平均增加,有趣的是,参与胆固醇从头生物合成途径的多种酶下调,说明其中的胆固醇积累源自胞外。
之前的工作表明富含胆固醇的髓磷脂碎片的吞噬作用会引发胆固醇积累和胆固醇生物合成关闭,为确认髓磷脂是否是LLMs中的主要脂质来源,他们先是用髓磷脂碱性蛋白(MBP)作为标记物探测TME中髓磷脂的存在,随后通过电镜观察证实LLMs吞噬体内存在髓磷脂碎片。为探究LLMs摄取髓磷脂碎片的意义,他们在体外用胶质母细胞瘤肿瘤条件培养基培养巨噬细胞,发现髓磷脂吞噬作用增强,而一般吞噬作用不增强,细胞内发生脂质累积,与此同时,引发H3K27me3上调,强调了髓磷脂在协调巨噬细胞获得LLM 表型相关基因表达变化中的作用。此外,他们还观察到这群细胞脂质转运蛋白表达增加,通过对肿瘤间质液(TIF)中脂质含量的测定,发现胆固醇从LLM中流出增加。
为了确定胶质母细胞瘤如何从LLM流出的脂质中获益,该团队设计了在不同髓磷脂暴露条件下的共培养试验,随后对肿瘤细胞进行定量脂质组学和转录组学分析。在单一培养条件下,仅暴露于髓磷脂的MES样细胞并未表现出脂质含量改变,因为它们无法吞噬髓磷脂碎片,但肿瘤细胞表现出应激相关基因上调,增殖相关基因下调,提示髓磷脂对肿瘤细胞的脂毒性。有趣的是,当在培养基中加入巨噬细胞,MES样肿瘤细胞中逐渐积累多种脂质,尤其是胆固醇和甘油三酯,在转录方面,与增殖和细胞周期途径相关基因上调。这些发现揭示了LLM和MES样肿瘤细胞之间的“共生关系”,胶质母细胞瘤细胞通过促进其脂质摄取能力来指导LLM的形成,LLM反过来通过胆固醇/胆固醇酯流出和脂质转移促进MES样胶质母细胞瘤细胞增殖。
最后,为了确定上述发现的临床意义,他们将TCGA和GLASS数据集中的原发性胶质母细胞瘤样本分为LLMlow和LLMhigh组,并确定LLMhigh组患者的预后明显较差,且LLMhigh组的大多数胶质母细胞瘤具有MES样特征。新辅助抗PD-1疗法最近已被纳入复发性胶质母细胞瘤的治疗中,且表现出显著的生存获益,于是该团队分析了接受此类治疗的患者scRNA-seq数据集,发现接受此疗法的患者LLM百分比显著降低,提示LLMhigh转录特征可能是他们对此疗法反应较差的原因,但由于缺乏对此疗法应答和无应答的数据集,因此该因果关系仍有待确定。
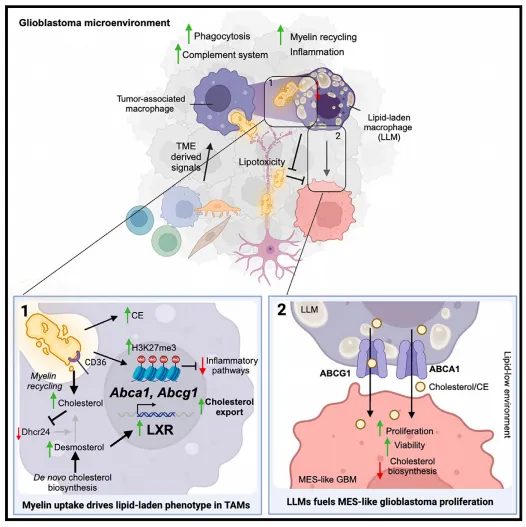
综上,这项工作证明MES样胶质母细胞瘤细胞通过与巨噬细胞的代谢串扰,即促进巨噬细胞摄取髓磷脂并加工成可被肿瘤细胞利用的脂质,进而促进自身的存活和增殖,这一机制的发现对于更新抗肿瘤治疗策略而言至关重要。
原文链接:https://doi.org/10.1016/j.cell.2024.07.030
