理解人类造血干细胞(Hematopoietic stem cells,HSCs)功能包括自我更新和维持等具有重要意义。对影响HSCs的罕见先天性遗传变异的机制解读是理解HSCs功能的的重要手段。位于MECOM基因的遗传变异所导致的单倍体不足(MECOM haploinsufficiency)会导致新生儿再生障碍性贫血等诸多血液疾病,然而其背后的机制仍旧不清楚。
2022年12月15日,美国哈佛大学医学院/博德研究所的Vijay Sankaran团队和Aviv Regev团队 (共同一作为Richard Voit, 陶利明和 于福龙)在Nature Immunology上发表了题为A genetic disorder reveals a hematopoietic stem cell regulatory network co-opted in leukemia的文章。发现MECOM基因介导的调控网络在造血干细胞维持和白血病中的调控机制。
通过在原代人类 HSCs中进行CRISPR/Cas9基因编辑,生成了由MECOM 单倍体不足所引起的罕见遗传病模型并结合单细胞测序分析,作者发现了一个涉及维持 HSC功能所需的由数百个基因构成的转录网络。为了进一步研究MECOM调控该程序的机制,作者开发了一个计算学框架,通过整合包括基因表达,染色质可及性,以及长距离基因组互作数据,以全面识别在造血系统中基因与cis调控元件之间的关联。作者进而识别了RUNX1, FLI1和 CTCF等一系列关键协同的转录调控因子。
通过结合基因扰动和转录因子基因组定位等实验对CTCF进一步分析,作者确定了 MECOM可能通过与CTCF竞争性的调控该转录调控网络,并能够阻止在HSC 分化过程中相应的CTCF介导的基因组重组。该调控网络基因在不同的临床数据中都显示了对急性髓性白血病(AML)病人有效的预后风险分层,而且AML细胞系中也证实了MECOM基因扰动影响了相似的转录调控网络。
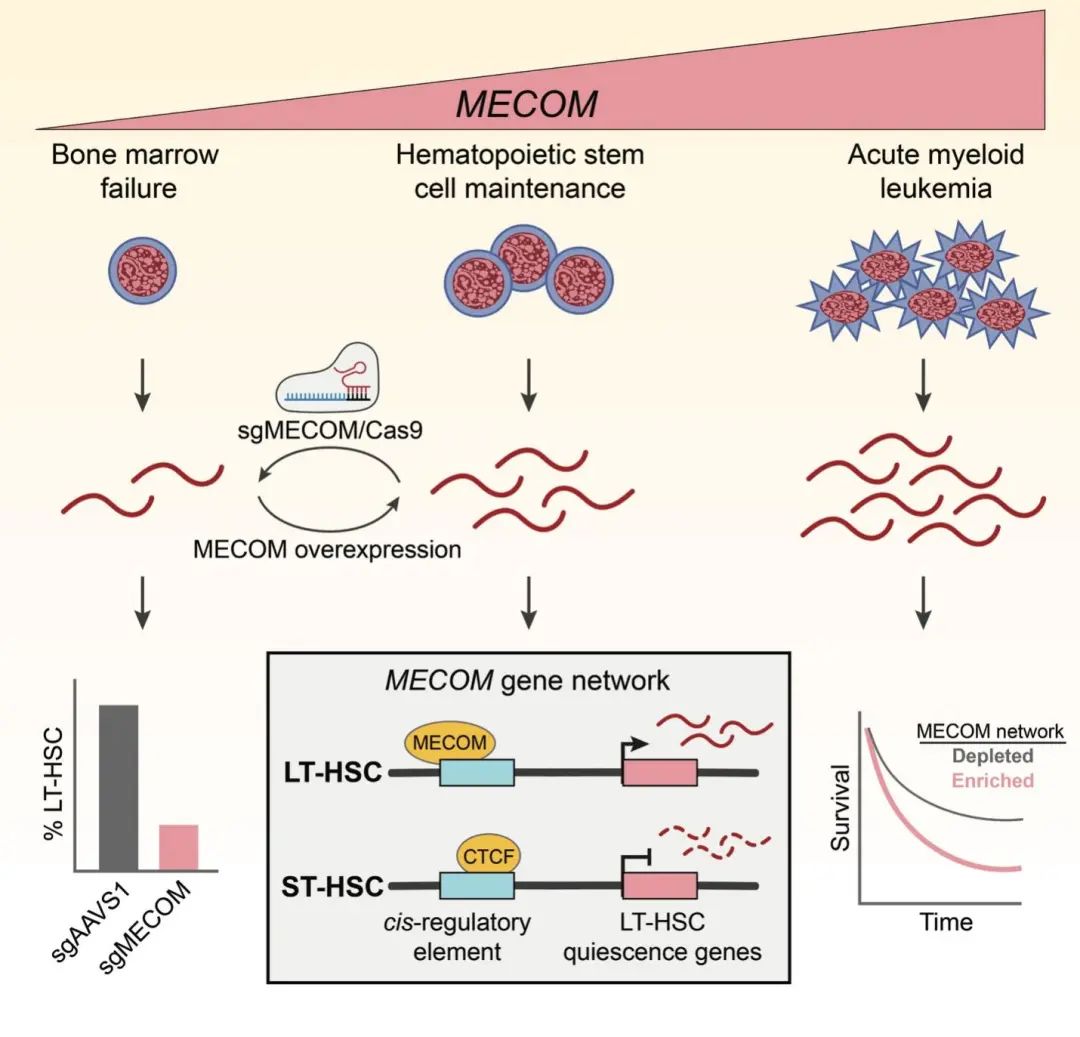
这项研究构建了MECOM单倍体不足模型并识别了所影响的关键的转录调控网络,证实了该网络对于维持HSC的必要性且对高风险的AML形成有所贡献。
