胆汁酸(Bile acids,BAs)在肝脏中积累可导致胆汁淤积肝损伤。如未得到及时治疗,将发展成为肝纤维化、肝硬化甚至肝衰竭。近期研究表明,肝内胆汁酸可通过刺激趋化因子(如CCL2、CXCL2)表达,趋化炎性细胞(如中性粒细胞)浸润,引发肝损伤。同时,胆汁酸可以通过触发炎症负反馈环路,如激活JAK/STAT3或P38/MAPK信号通路,减轻胆汁淤积肝损伤。然而,是否有其他机制参与调控胆汁酸诱导的肝损伤仍有待明确。
近日,Hepatology在线发表陆军军医大学第一附属医院(西南医院)消化内科、全军消化病研究所柴进教授团队的题为Hepatic GDP fucose transporter SLC35C1 attenuates chole static liver injury and inflammation by inducing CEACAM1 N153 fucosylation的研究。该研究团队发现胆汁酸上调肝脏SLC35C1表达而促进粘附蛋白CEACAM1岩藻糖基化,从而抑制CCL2和CXCL2表达及肝脏炎症,发挥减轻胆汁淤积肝损伤效应。
SLC35C1编码核苷酸糖转运蛋白,将细胞质中的GDP-岩藻糖转运到高尔基体和内质网管腔中,以促进蛋白质糖基化。SLC35C1广泛表达在肝脏等多种组织器官中,能将GDP-岩藻糖转运到高尔基体,促进蛋白的岩藻糖基化修饰。人类SLC35C1基因突变可导致白细胞粘附缺陷II(LADII),主要表现为反复感染和炎症发生。前期已有研究发现SLC35C1在原发性肝细胞癌及肝内胆管癌中表达升高,但在其他肝脏疾病,尤其是在胆汁淤积肝病中的作用仍是未知。
研究者发现在人胆汁淤积肝组织及小鼠胆汁淤积模型肝脏中,SLC35C1表达明显升高。为明确SLC35C1高表达在胆汁淤积肝病中发挥的生物学功能,研究者利用Slc35c1肝脏特异性敲除小鼠构建胆汁淤积模型,发现小鼠肝脏中Slc35c1缺乏显著加重了胆汁淤积性肝损伤及炎症,却没有肝脏胆汁酸的明显积聚。同时,研究者发现胆汁淤积下Slc35c1肝脏特异性敲除小鼠肝组织中趋化因子Ccl2和Cxcl2及其受体表达明显升高,而在Slc35c1基因敲除小鼠原代肝细胞中过表达Slc35c1可抑制胆汁酸诱导的Ccl2和Cxcl2表达。
为了研究SLC35C1如何抑制胆汁酸诱导的CCL2和CXCL2的表达,研究者将Slc35c1基因敲除胆道结扎小鼠和对照组小鼠肝组织进行糖基化蛋白组学分析,发现基因敲除小鼠肝脏中Ceacam1蛋白的153位点N糖基化修饰较对照组明显降低。进一步研究发现SLC35C1过表达可显著增加CEACAM1岩藻糖基化。通过转染CEACAM1-N153A突变质粒或2FF(岩藻糖基化抑制剂)处理,证明SLC35C1通过促进 CEACAM1蛋白153位点N糖基化,从而抑制胆汁酸诱导的CCL2和CXCL2表达。
在机制上,STAT3抑制剂处理后明显抑制胆汁酸刺激的SLC35C1表达,提示在胆汁淤积肝细胞中STAT3信号激活可促进SLC35C1表达。进一步通过双荧光素酶报告基因及染色质免疫共沉淀技术,证明转录因子STAT3能靶向上调SLC35C1启动子的转录活性。
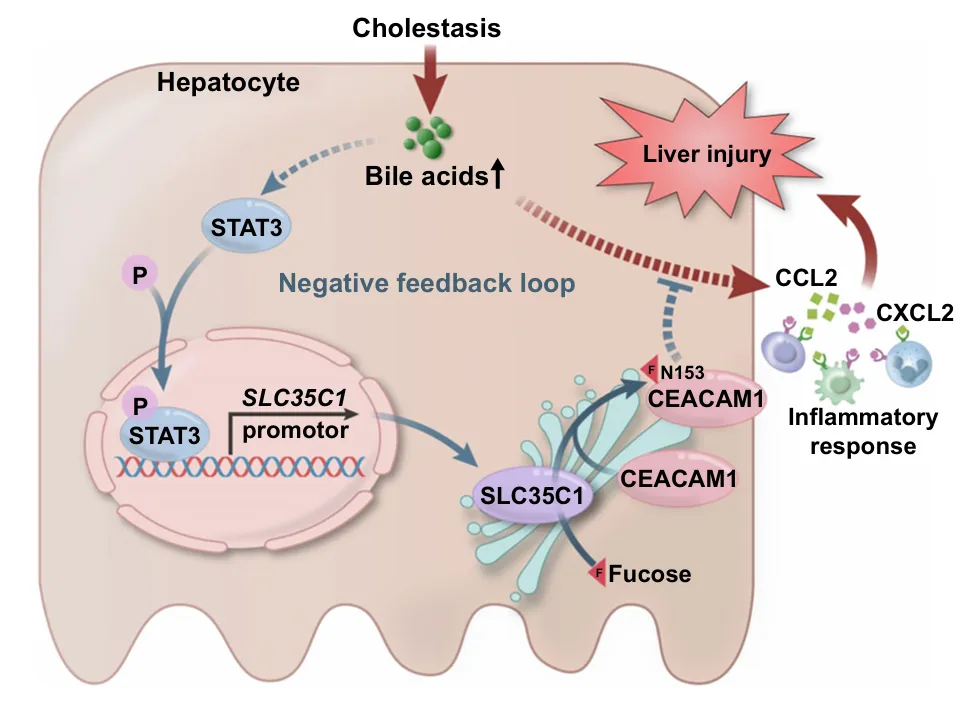
综上所述,肝细胞内淤积的胆汁酸通过激活STAT3信号通路上调岩藻糖转运蛋白SLC35C1表达,而增加粘附蛋白CEACAM1的岩藻糖基化,从而抑制趋化因子(CCL2、CXCL2)表达,发挥炎症负反馈调控、减轻胆汁淤积肝损伤的效应。该研究结果表明,诱导肝脏SLC35C1的表达可能是治疗胆汁淤积的新策略。
原文链接:https://doi.org/10.1097/HEP.0000000000001003
