心肌梗死引起线粒体活性氧产生和心肌细胞凋亡。Nrf3(核因子红系2相关因子3)在调节氧化还原信号和组织稳态中具有确定的作用。
2025年3月18日,上海交通大学张力、英国伦敦玛丽女王大学肖庆忠共同通讯在Circulation(IF=35.5)在线发表题为“Nrf3-Mediated Mitochondrial Superoxide Promotes Cardiomyocyte Apoptosis and Impairs Cardiac Functions by Suppressing Pitx2”的研究论文,该研究发现Nrf3介导的线粒体超氧化物通过抑制Pitx2促进心肌细胞凋亡并损害心脏功能。
研究发现Nrf3通过抑制Pitx2表达增加线粒体ROS生成,促进损伤诱导的CM凋亡并恶化心脏功能。因此,靶向Nrf3–Pitx2––线粒体ROS信号轴可能是治疗心肌梗死的一种新的治疗方法。
心肌梗死(MI)仍然是世界范围内死亡的主要原因,也是慢性心力衰竭的主要原因。MI患者心脏损伤的最显著特征之一是由于缺乏氧气和能量供应导致的大量心肌细胞(CM)死亡。CM死亡的程度是短期心脏破裂和长期病理性心脏重塑的关键决定因素。心脏损伤产生大量的活性氧(ROS),绝大多数细胞ROS (90%)来自线粒体室。线粒体ROS可以直接或间接导致CM死亡;因此,在心脏损伤期间抑制过量的线粒体ROS被认为是抑制心肌梗死后心肌细胞死亡和改善心脏功能的有效方法。然而,仍然缺乏有效和特异性靶向受损心脏中线粒体ROS产生的药物,这突出了未满足的医疗需求。
Nrf3是最新发现的cap“n”环-碱性亮氨酸拉链转录因子家族成员,该家族还包括Nrf1和Nrf1。cap“n”环域有助于这些转录因子独特的DNA结合特异性。通过直接结合目标基因启动子区域内的抗氧化反应元件(ARE ),据报道Nrf3可转录抑制或激活其目标基因。具体而言,已有文献证明Nrf3抑制抗氧化基因如Nqo1 (NAD(P)H:醌氧化还原酶1)和peroxiredoxin的表达,但促进Nox4 (NADPH氧化酶4)10和Pla2g7基因转录,表明细胞依赖性转录调节。
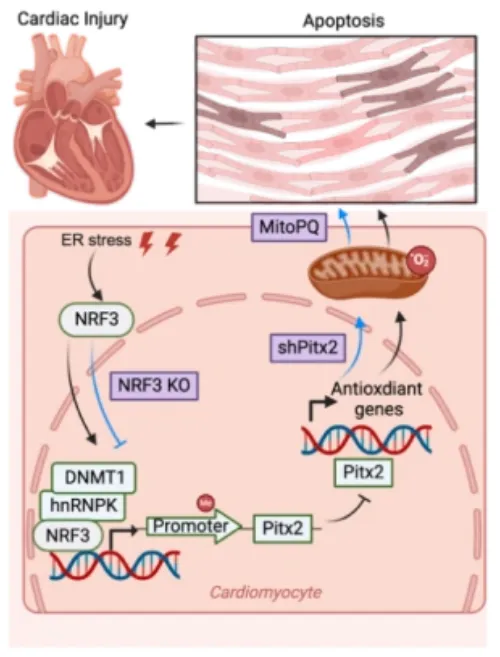
机理模式图(图源自Circulation)
与它的两个同源物不同,对Nrf3的病理生理学作用的了解是有限的。通过赋予癌细胞选择性生长优势并促进癌症恶性相关过程,包括转移和血管生成,Nrf3被认为是一种癌基因。最近记录了Nrf3在脂质体内平衡中的功能作用,支持其在脂质相关疾病中的意义。之前报道了Nrf3介导的ROS在平滑肌细胞从干细胞分化中的关键作用,表明Nrf3与Nrf2不同,通过促进而不是抑制ROS的产生来参与氧化还原信号调节。
在这里,研究发现心脏损伤诱导ER应激,ER应激诱导Nrf3表达。增加的Nrf3通过与Pitx2基因启动子区域内的ARE基序直接结合,与hnRNPKDNMT1复合物相互作用,并将hnrnpkdnmt 1复合物募集到Pitx2基因启动子。累积的DNMT1在Pitx2基因启动子内的CpG岛建立了高水平的甲基化,从而抑制其基因转录。该研究证明了Nrf3,一种新的线粒体活性氧产生的调节剂,在缺血性损伤诱导的病理性心脏重塑中起着重要作用。
参考消息:https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.124.070286
