1型糖尿病(T1D)是一种以胰腺β细胞损伤为特征的自身免疫性疾病。病程中,胰腺内分泌区的交感神经元发生丢失,而胰岛周围外分泌区的交感神经元则保持完整。这种异常的交感神经信号可能破坏神经 - 内分泌 - 免疫网络的平衡,进而促进 1 型糖尿病的发生发展,但其潜在分子机制尚未明确。
2025年11月16日,华中科技大学向明唯一通讯在Advanced Science(IF=14.1)在线发表题为“CARD9 Conveys Pancreatic Islet Sympathetic Nervous β2 Signals to Reshape Macrophage Creatine Metabolism in Type 1 Diabetes”的研究论文。本研究通过单细胞组学和全组织免疫染色,揭示了1型糖尿病患者和1型小鼠模型中胰交感神经密度的下降。交感神经系统的手术去敏化和化学去敏化会加剧1型糖尿病病情,而巨噬细胞耗竭则可缓解这一效应。
机制上,去甲肾上腺素(NE)释放减少会损害胰岛巨噬细胞中的β2肾上腺素能受体(β2-AR)-PKA-CREB1信号通路,导致衔接蛋白半胱天冬酶募集域家族成员9(CARD9)表达下调。CARD9缺失会降低SLC6A8介导的肌酸摄取,使巨噬细胞向促炎表型转化,并通过减少神经营养因子和抗炎因子的释放,诱导交感神经轴索铁死亡。相反,β2-AR激动剂福莫特罗可恢复PKA-CREB1-CARD9通路的激活,维持肌酸代谢稳态,并保持巨噬细胞的抗炎表型极化。这些研究结果揭示了一条由CARD9调控的新型“交感神经-巨噬细胞-肌酸代谢”轴,该轴将神经信号与1型糖尿病中的免疫调控和代谢调控相连接,为以神经-免疫相互作用为靶点的治疗策略提供了理论依据。
1型糖尿病(T1D)是一种慢性自身免疫疾病,其特征是免疫系统有针对性地破坏胰腺β细胞。在胰腺内,交感神经系统发挥多方面的调控作用。在T1D早期,仅胰腺内分泌区的交感神经元发生选择性丢失,而外分泌区的交感神经元则保持完整。这种区域性去神经支配可能破坏神经-免疫-内分泌网络的稳定性,既加剧对β细胞的自身免疫攻击,又促进局部神经退行性变。
胰腺中的巨噬细胞与交感神经元密切接触,可能参与T1D发展过程中神经免疫信号的传递。巨噬细胞在T1D患者胰岛和神经元的炎症浸润中起着关键作用。作为抗原呈递细胞,它们处理β细胞抗原并将其呈交给T细胞,触发自身免疫反应,同时释放促炎因子白介素-1β(IL-1β)和肿瘤坏死因子α(TNF-α),这些因子直接损害β细胞。此外,巨噬细胞来源的因子可促进邻近神经元的脂质过氧化,使其在铁过载条件下更易发生铁死亡。相反,替代激活型巨噬细胞分泌的抗氧化介质可抑制神经元铁死亡,从而调节神经免疫平衡。
Caspase招募域成员9(CARD9)在巨噬细胞和树突状细胞(DC)中高度表达,同时参与先天免疫和适应性免疫。作为核心信号枢纽,CARD9能够整合多种信号、激活下游分子级联反应,并调控细胞代谢以维持稳态。已有研究表明,CARD9与多种疾病相关。然而,迫切需要探索CARD9在1型糖尿病和神经病变中特异性的作用。
先前研究发现,CARD9的表达水平与细胞内肌酸(Cr)代谢及其转运蛋白溶质载体家族6成员8(SLC6A8)表达密切相关。含氮氨基酸Cr在调节巨噬细胞极化和发挥神经保护作用中起着关键作用。补充Cr已被证明减弱促炎巨噬细胞的激活。同时,它增强IL-4-STAT6-精氨酸酶1(ARG1)轴,促进抗炎巨噬细胞的极化。除了免疫调节功能外,肌酸还可通过磷酸肌酸(PCr)系统快速再生ATP,为神经元突触活动提供充足能量,进而参与神经元能量代谢。
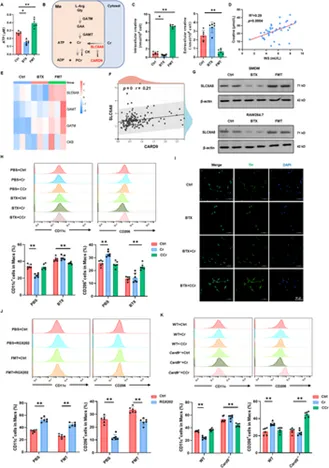
β2-AR信号通过CARD9调控的肌酸转运介导巨噬细胞极化(摘自Advanced Science)
在这项研究中发现胰腺交感神经系统经历选择性退化,同时发生动态巨噬细胞重塑。化学和手术抑制交感神经活动都会加重1型糖尿病进展,而巨噬细胞耗竭则抵消了这一效应。CARD9作为巨噬细胞交感神经β2-AR-PKA-CREB1信号传导的关键下游效应因子。当CARD9下调时,SLC6A8介导的Cr摄取受损,促使巨噬细胞趋向促炎表型,并增加促炎细胞因子的分泌,加速T1D进展。此外,巨噬细胞CARD9通过调节炎症细胞因子和神经营养因子的产生,影响交感神经丧失并促进铁坏死。这些发现阐明了1型糖尿病神经免疫网络失调和神经病变发病机制的新机制,强调了开发新治疗干预的潜在神经保护方法。
原文链接:https://doi.org/10.1002/advs.202507543
