胰腺导管腺癌(PDAC)是一种高致死率的肿瘤,治疗方案有限。
2023年2月24日,天津医科大学郝继辉、黄崇标及美国宾夕法尼亚州立大学Shengyu Yang共同通讯在Gut(IF=32)在线发表题为“SDCBP promotes pancreatic cancer progression by preventing YAP1 from β-TrCP-mediated proteasomal degradation”的研究论文,该研究表明SDCBP通过阻止YAP1 β-TrCP介导的蛋白酶体降解来促进胰腺癌进展。结果表明,高SDCBP组的中位总生存率和无复发生存率明显短于低SDCBP组。体外和体内研究表明,SDCBP促进PDAC增殖和转移。
在机制上,SDCBP抑制CK1δ/ε-介导的YAP- S384/S387磷酸化,进而通过直接与YAP1相互作用抑制β-TrCP介导的YAP1泛素化和蛋白酶体降解。SDCBP主要通过其PDZ1结构域与YAP1的TAD结构域相互作用。临床前KPC小鼠队列研究表明,吡啶硫酮锌(ZnPT)通过抑制SDCBP抑制PDAC肿瘤进展。SDCBP通过阻止YAP1 β-TrCP介导的蛋白酶体降解促进PDAC的增殖和转移。因此,ZnPT可能是一种通过抑制SDCBP来抑制PDAC进展的有前景的治疗策略。
胰腺导管腺癌(PDAC)是一种高度致命的恶性肿瘤,具有积极的临床病程和有限的治疗方案。过去几十年的进展极大地提高了癌症患者的总生存期(OS)。然而,胰腺癌仍然对大多数治疗方法具有耐药性,5年相对生存率<10%。目前迫切需要识别胰腺癌治疗的新靶点。突触结合蛋白(SDCBP),也称为突触结合蛋白1或黑色素瘤分化相关基因9,是PDZ(突触后密度蛋白(PSD95/SAP90)、果蝇大肿瘤抑制因子(DLGA)和封闭小带1(ZO-1))蛋白家族的成员。Fisher的实验室首次发现SDCBP是黑色素瘤转移的阳性调节因子。SDCBP已被证明是实体肿瘤中几个重要生物学功能的主要贡献者。Zu等人最近的研究也报道了SDCBP在PDAC进展中的致癌基因;然而,SDCBP的功能、机制和转译尚未得到充分的研究。![]()
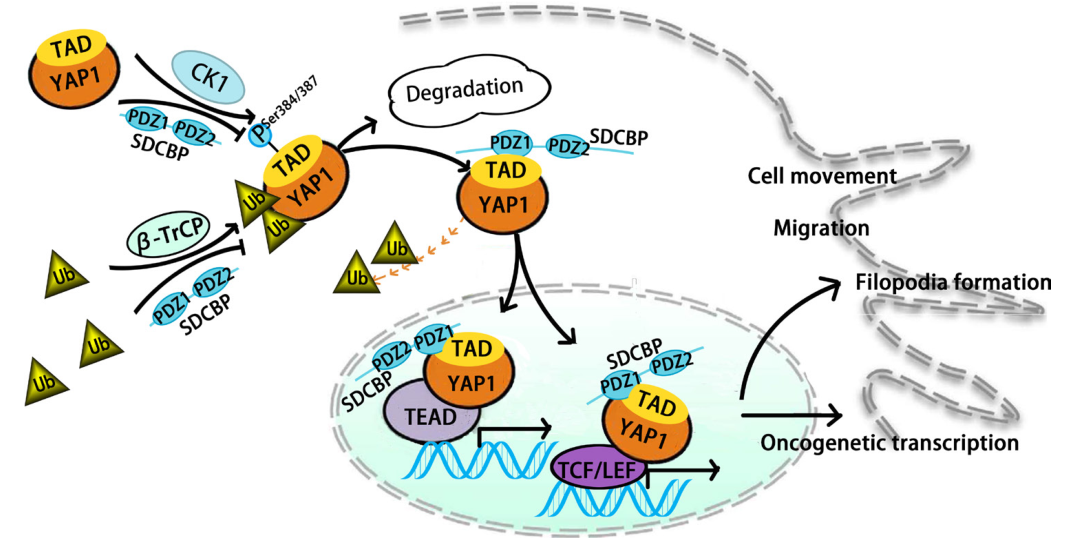
机理模式图(图源自Gut )
Yes相关蛋白1 (YAP1)是Hippo信号通路下游的一种转录辅激活子,对PDAC的形成和发展至关重要。YAP1不仅在PDAC启动过程中与KRAS合作,而且还可以替代KRAS,以取代最具侵略性的晚期PDAC亚型的生存。虽然Hippo网络是控制YAP活性的主要机制,但最近的研究已经确定了Hippo途径独立的机制,调节YAP的定位和活性。YAP1在PDAC中的其他修饰的发生和精确意义在很大程度上仍然未知,因此,需要进一步的实验工作。该研究探索了SDCBP通过其PDZ1结构域与YAP1相互作用。这种相互作用阻止了CK1δ/ε-介导的YAP- S384/S387磷酸化和β-T rCP-介导的蛋白酶体降解。通过筛选也发现了靶向SDCBP的有前景的药物,ZnPT是一种有前途的SDCBP抑制因子,可抑制PDAC的进展。原文链接:https://gut.bmj.com/content/early/2023/02/23/gutjnl-2022-327492
