许多多亚基复合物的生物合成过程依赖于调控各亚基之间相互作用以及有序装配。与之相对的是,调控因子SCF(SKP1-CUL1-F box protein)E3泛素连接酶时刻进行着成建制动态装配和解离,集合包含~70个不同的F box蛋白质(Fbps)特异性复合物依赖于CAND1的安装和拆卸。CAND1的主要功能是感应和打破失活SCFs的稳定状态,而忽略那些已经泛素化的亚基。基础E3连接酶依赖的生物调控过程—包含真菌的代谢途径,植物的植物激素信号通路以及人类对不同细胞因子、氧化还原压力、DNA损伤试剂以及降解类药物的多种响应等—均依赖于CAND1。
SCFs是CRL(cullin-RING ligase)E3酶超家族的成员之一。它由两组已预装配完成的亚复合物构成,CUL1-RBX1复合物可以启动招募至SKP1-Fbp亚基泛素化。Fbps可以识别降解决定子(degron)结构亚基。
SCFs全酶复合物的形成可以通过体外混合CUL1-RBX1和SKP-Fbp来实现。在细胞中,SCF依赖的泛素化可以通过多种机制来调控,并且同时活化和标记底物。而底物的结合通常是由决定子的变化来调控的,比如磷酸化。E3连接酶的活性通常还依赖于UB样蛋白NEDD8对CUL1的C端WHB结构域修饰,而这一过程是通过与泛素化类似的多酶接合作用(neddylation)级联反应来实现的。通过CSN去接合作用酶将NEDD8从CUL1解离下来,就会导致SCFs失活。
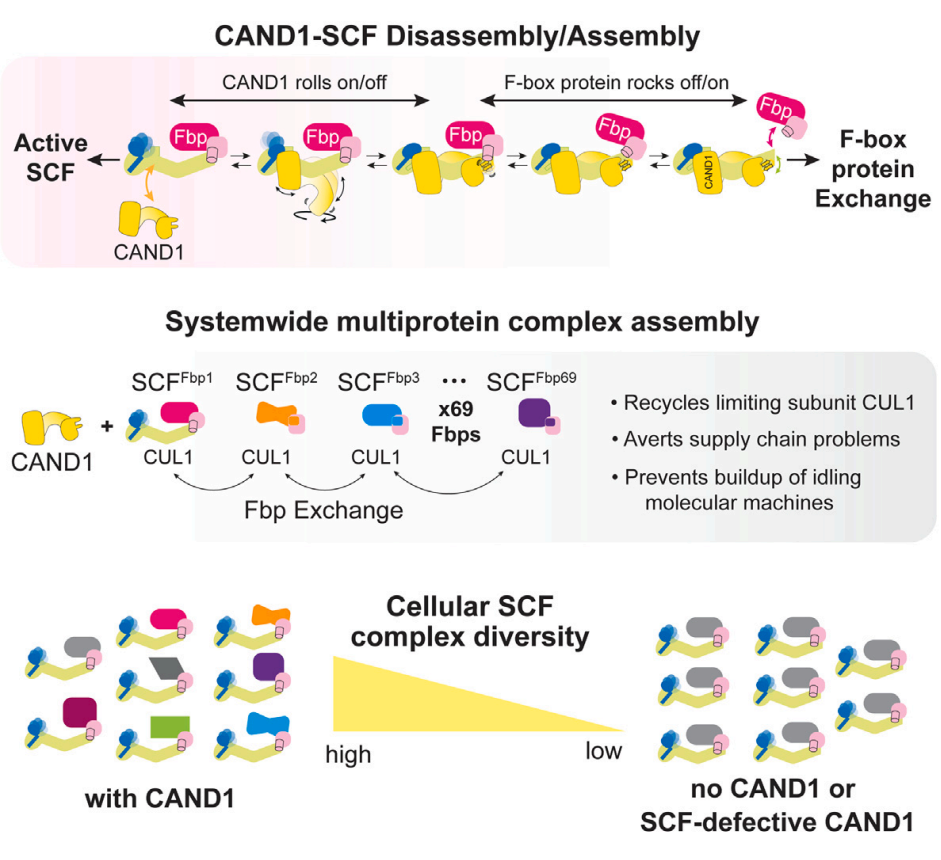
细胞需要CAND1和CSN来维持SCF功能的核心原因是这两个因子可以杜绝SCFs自发合成的可能性。另外,纯化的SCFs生化性质稳定,解离为CUL1-RBX1和SKP1-Fbp亚基通常需要数天之久,因此,已经合成的SCFs可以起到收纳CUL-RBX1以及防止新的SCFs合成的作用。当然,生化实验证实,CAND1参与消耗过量Fbps。在CAND1充足情况下,去接合的SCFs可以释放部分SKP1-Fbp亚复合物。与之相对的是,添加SKP1-Fbp复合物可以导致CAND1从相对稳定的CAND1-CUL1-RBX1复合物中解离出来。另外,体外泛素化检测发现,CAND1可以通过拆散其他SCF来获得CUL1-RBX1,从而促进游离SKP1-Fbp亚复合物形成新的SCF。最后,通过对超过40组人类SCF复合物进行蛋白质组学检测发现,细胞内的Fbp1与CUL1结合需要依赖于CAND1以及相应的接合-去接合通路。
细胞中的SCF泛素连接酶复合物库参与调控多种蛋白质降解,且这一过程需要CAND1来限制CUL1亚基与近70种不同Fbox蛋白质的布局。但是,这样单独一个因子是如何协调多种不同多蛋白复合物装配的,也就是SCF复合物是如何通过CAND1依赖的方式进行装配的,仍旧不清楚。
近日,来自德国Max Planck Institute of Biochemistry的Brenda A. Schulman研究组在Cell上发表题为Systemwide disassembly and assembly of SCF ubiquitin ligase complexes的文章,就上述问题进行了深入研究。
作者通过冷冻电镜(cryo-EM)获得多种状态下结合有CAND1的SCF复合物结构,并进一步将结构、生物化学指标以及细胞生物学数据与突变效应整合和关联起来。结果显示,CAND1搭扣关闭了失活状态的SCF的催化结构域,并进行翻转、变构,打破SCF稳定状态。而新的SCF生成过程与之基本相反,也就是通过SKP1-Fbox蛋白质异构,使得CAND1结构不稳定。CAND1-SCF构象可以对失活状态的复合物中的CUL1循环再利用,从而在底物存在情况下激活SCF各组分之间的排列组合,启动E3活化。
综上所述,作者的工作揭示了E3连接酶家族的生物合成过程,并且也解锁了多蛋白复合物装配的分子基础。
原文链接:https://doi.org/10.1016/j.cell.2023.02.035
