最近在多足动物中发现了广谱热受体1 (BRTNaC1),它在低细胞外pH值下受热激活。虽然BRTNaC1的过表达导致了具有阳离子选择性分布的强热激活电流,但是这种受体的结构以及它是如何被质子和热门控的仍有待研究。
2025年2月26日,浙江大学杨帆、苏楠楠、东北林业大学杨仕隆共同通讯在Nature Structural & Molecular Biology(IF=12.5)在线发表题为“Structure and function of a broad-range thermal receptor in myriapods”的研究论文,该研究揭示了BRTNaC1通道的质子激活和热激活机制。
该研究确定了BRTNaC1在apo,质子诱导和加热状态下的低温电子显微镜结构。基于这些结构,膜片钳记录和分子动力学模拟,发现“扭转手腕”机制用于BRTNaC1的质子活化,而热诱导BRTNaC1广泛的构象变化,包括跨膜螺旋的旋转和移动以打开该通道。此外,由于睾酮抑制BRTNaC1激活,确定了四个对这种抑制作用重要的聚集残基。因此,该研究为BRTNaC1离子通道中的配体和温度门控建立了结构基础。
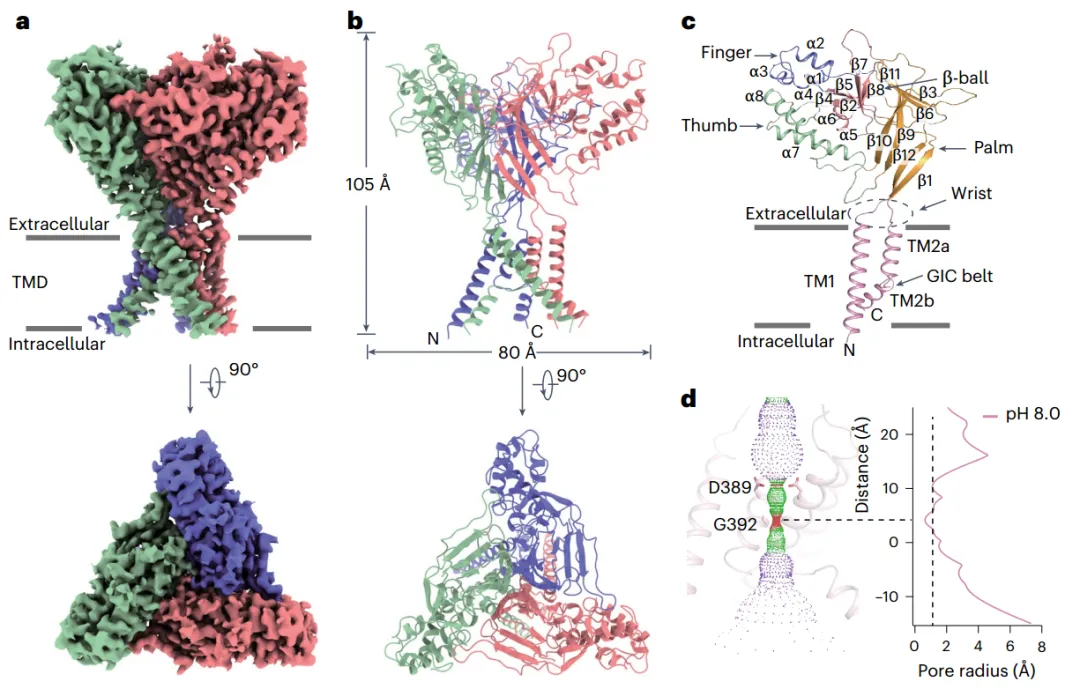
感知环境,如外部亮度、温度和各种化学刺激,对所有生物的生存至关重要。虽然脊椎动物中的G蛋白偶联受体1和离子通道2使其能够敏感地检测环境线索,但在多足类动物等无脊椎动物中,关于它们如何检测环境刺激的信息却知之甚少。研究发现宽范围热受体1 (BRTNaC1)离子通道在蜈蚣的触角中表达,在那里它被触角中阳光照射的光热效应产生的热量激活,从而启动回避行为。BRTNaC1通道属于degenerin(DEG)/上皮钠通道(ENaC)家族,其中成员是三聚体离子通道,每个亚单位中有两个跨膜(TM)域。然而,BRTNaC1是否共享类似的架构仍然未知。
DEG/ENaC家族中的这些成员在功能上各不相同,例如,ENaC和DEG通道分别对钠稳态和机械感觉至关重要,而酸敏感离子通道(ASIC)检测质子梯度。具体来说,BRTNaC1与从水蚤Daphnia pulex的基因组中预测的ASIC1b样蛋白显示出最高的序列相似性(~22%)。有趣的是,BRTNaC1的热激活需要细胞外溶液的低pH值(pH ~6.0),尽管我们测试的许多DEG/ENaC蛋白(ASIC1a、ASIC2a和ASIC3)和P2X受体(P2X3、P2X4和P2X7)不能被热激活。虽然已经证明BRTNaC1通道介导的热激活电流具有有利于单价阳离子渗透的离子选择性分布,但该通道的选择性过滤器仍有待进一步研究。此外,由于BRTNaC1需要细胞外酸化被热激活,它如何检测质子和热并受其控制仍然难以捉摸。
![]()
![]()
BRTNaC1在apo状态下的整体结构(图源自Nature Structural & Molecular Biology )
该研究解析了BRTNaC1在pH 8.0和pH 4.0以及4°C和40°C下的三维(3D)结构,并可能解析了睾酮(测试)结合状态。这些高分辨率的结构,加上分子动力学(MD)模拟,进一步指导了定点突变和膜片钳记录,以揭示BRTNaC1中配体和热门控的结构机制。该研究验证了杨帆团队提出的关键氨基酸包埋/暴露动态构象变化介导离子通道温度感受的机制,不仅在TRPM8等哺乳动物的温度感受器上适用,在低等动物的热感受器BRTNaC1上同样适用,为最终理解生命体对温度的感知打下了坚实基础。
参考消息:https://www.nature.com/articles/s41594-025-01495-8
