细胞器间的快速分子与物质交换对协调细胞生理活动至关重要,而细胞器间的互作和物质交换主要发生在细胞器间的直接接触位点(contact sites)区域。近年来研究发现这些细胞器接触位点会使细胞器彼此接近,但不会融合,它们之间的相互作用具体是通过分子系链(molecular tethers)介导的,这些系链提供了蛋白质-蛋白质或蛋白质-脂质的分子连接。
哺乳动物细胞中研究最多的细胞器接触位点是内质网(ER)与线粒体之间的接触位点ERMCS,该接触方式与脂质合成和分解、钙信号传导和细胞呼吸等密切相关。然而,由于这些结构对外界条件非常敏感,甚至在单个细胞中也表现出显著的异质性。因此,基于生物化学的方法常常受到实验条件的影响,而大多数现有的标记技术对ERMCS的大小、结构和调节都会带来干扰,技术因素是制约我们理解ERMCS分子组分和亚结构动态调节机制的重要瓶颈。
近日,霍华德休斯医学研究所(HHMI)Janelia Research Campus的Jennifer Lippincott-Schwartz实验室在Nature杂志发表了题为“Motion of VAPB molecules reveals ER–mitochondria contact site subdomains”的研究文章,作者通过将三维电子显微技术与高速分子跟踪技术相结合,开发了一种改进的单粒子追踪光激活定位显微技术。作者成功利用该技术对高度保守的ER系链蛋白VAPB及其线粒体结合伴侣PTPIP51的结构和动态扩散模式进行了表征,不仅揭示了ERMCS能够随着细胞内环境变化发生重塑,以满足细胞的代谢需求,而且证明了VAPB突变损害了ERMCS的重塑能力,导致细胞通讯异常和肌萎缩性侧索硬化症(ALS)的发生。
内质网与线粒体之间的特定接触位点由成对的分子系链在转录过程中介导,目前了解较多的ERMCS系链是位于内质网上的VAPB(Vesicle-associated membrane protein (VAMP)-associated protein B,囊泡相关膜蛋白-相关蛋白B)和线粒体外膜(OMM)上的PTPIP51(蛋白酪氨酸磷酸酶相互作用蛋白51)(图1a),二者间的互作能够促进钙和脂质转移,其互作异常可能会导致肌萎缩侧索硬化症(ALS,即渐冻症)的发生。
作者首先使用聚焦离子束扫描电子显微镜(FIB-SEM)观测了VAPB-PTPIP51互作和ERMCS的3D结构,发现ERMCS常出现在线粒体嵴的基部或OMM收缩区域(图1)。随后利用单粒子追踪-光激活定位显微镜(sptPALM)在活细胞动态环境中跟踪了单个VAPB分子的运动,并捕获了ER的位置,作者发现VAPB分子在接触位点的停留时间非常短暂,大多数分子在毫秒时间尺度上就离开了接触位点,这种动态交换的速率几乎是“ER-细胞质膜”接触位点上分子的10倍,这突显了该界面上VAPB和其他分子的快速重排。
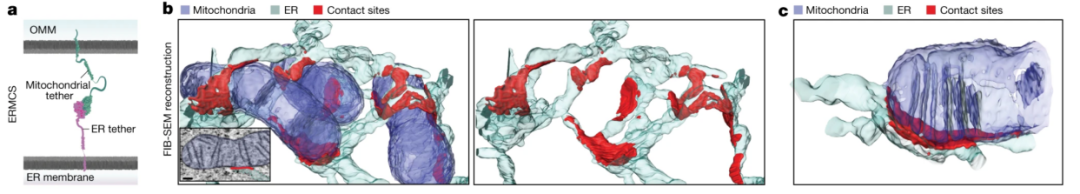
图1 利用FIB-SEM技术对ER-线粒体接触位点进行3D重建和表征
接下来,作者利用非参数贝叶斯方法定量监测了这些瞬态相互作用,发现ERMCSs内的VAPB分子仍保留了扩散运动的特征,而ERMCSs内VAPB富集的中心区域中VAPB系链丰度最高,这可能代表了接触位点中粘附力最大的区域。此外,FIB-SEM数据和VAPB分子扩散模式都支持ERMCSs中存在具有更高VAPB丰度和更大粘附性质的中心亚区域,接触位点中的粘附系链力并不会均匀分布在整个接触位点结构中,而是优先富集在中心亚域中。
随后作者通过过表达VAPB或PITPIP51后观察ER和线粒体的形态,评估了ERMCS大小与系链分子可用性(availability)间的依赖关系,发现ER和线粒体形态对VAPB的过表达不敏感,但在过表达PTPIP51时出现了显著的重排,此时ER完全包裹了大多数线粒体,然而sptPALM数据显示细胞中接触位点的总数没有增加。高度过表达VAPB和PTPIP51的细胞中ER的VAPB池发生耗竭,但VAPB富集于接触位点,因此,线粒体系链分子的可用性控制了ER和线粒体之间的VAPB介导的接触位点稳态。
那么,ERMCS结构和动态是如何适应满足细胞不同生理需求的呢?作者发现饥饿胁迫虽然会诱导ERMCS变大,但其动态特性仍能够保存。VAPB分子高度富集于接触位点中央的亚结构,并能够快速进出接触位点,ERMCS的动态变化会重塑形成扩张性界面,在饥饿条件下使ER和线粒体能够进行更有效的代谢产物交换以维持细胞生存。VAPB基因突变是导致ALS的原因之一,作者继续探究了VAPB的致病性突变是否影响了接触位点的动态特征。结果表明致病性VAPB突变通常会诱导聚集性的功能异常VAPB的产生,突变的VAPB富集于ERMCS的中心区域,但动态扩散能力减弱。因此,导致ALS发生的突变型VAPB在ER中靶向ERMCS,并引起接触位点的动态性特征紊乱,细胞通讯功能发生异常,这也是ALS的潜在病因。
线粒体-内质网间的互作是细胞代谢的中心枢纽,调节着细胞器之间的脂质和代谢产物交换。本研究将FIB-SEM结构分析与单粒子跟踪技术相结合,直观地解析了“内质网-线粒体”接触位点(ERMCS)的动态变化机制及可塑性调节的原理。发现ERMCS能够随着细胞内环境的变化进行重塑,以满足细胞的代谢需求。VAPB中与ALS相关的突变扰乱了ERMCS的区域性稳态,影响其重塑能力,导致细胞间通信受损,甚至ALS的发生。本研究为利用高速单分子定位追踪和成像技术探索细胞器接触位点的动态变化景观与调节机制奠定了基础。
原文链接:https://doi.org/10.1038/s41586-023-06956-y
