胰腺导管癌(Pancreatic ductal adenocarcinoma,PDAC)因其极低的生存率被称为"癌中之王",临床治疗仍面临严峻挑战。当前胰腺癌靶向药物选择极为有限,仅少数患者能从现有治疗中获益。加之胰腺癌对现有的治疗手段如放化疗等均不敏感且存在很强的耐药性。因此,发现新的有效治疗胰腺癌的分子靶点并研发创新药物具有重要的临床意义。
近日,湖北工业大学生命科学与健康工程学院、科技部/教育部细胞调控与分子药物“111”引智基地唐景峰、周策凡课题组在Signal Transduction and Targeted Therapy(IF=52.7)发表了题为“Serine/threonine/tyrosine kinase 1 drives pancreatic carcinogenesis via GSK3β sequestration-mediated Wnt/β-catenin pathway hyperactivation”的科研成果(DOI : 10.1038/s41392-025-02292-x)。团队通过构建高度模拟人类疾病特征的自发肿瘤动物模型,结合临床样本分析,揭示STYK1表达水平与胰腺癌患者不良预后密切相关。阐明了STYK1通过GSK3β囊泡包裹进而促进Wnt/β-catenin信号通路的分子机制,同时筛序并获得了靶向该通路活性的短肽药物前体,并在斑马鱼、小鼠等动物模型验证了其作用效果。
Wnt/β-catenin信号通路与胰腺癌的演化、进程高度相关。β-catenin(β-连环蛋白)是Wnt信号通路的中枢分子,其在未激活时被AXIN1-GSK3β-APC复合体磷酸化并降解。该研究阐明STYK1能够结合β-连环蛋白和糖原合成酶激酶GSK3β,破坏蛋白质降解复合体的正常组装;同时介导GSK3β向多泡体的定向转运,导致其生物学功能失活。受体介导的内吞作用(Receptor-mediated endocytosis)是一种高度选择性的细胞机制,通过该机制,大分子货物(如配体-受体复合物)在严格调控下被细胞内化。团队进一步分析发现,STYK1蛋白中存在保守的酪氨酸分选基序(Y191QRL194)和双亮氨酸分选基序(GDLL203-204),这些基序介导了Clathrin/AP2蛋白复合体依赖的内吞作用,这对GSK3β的隔离至关重要。STYK1 Y191位点被BLK激酶磷酸化后,可增强其与AP2的相互作用,从而加速GSK3β的隔离及其后的Wnt/β-连环蛋白信号通路活化。
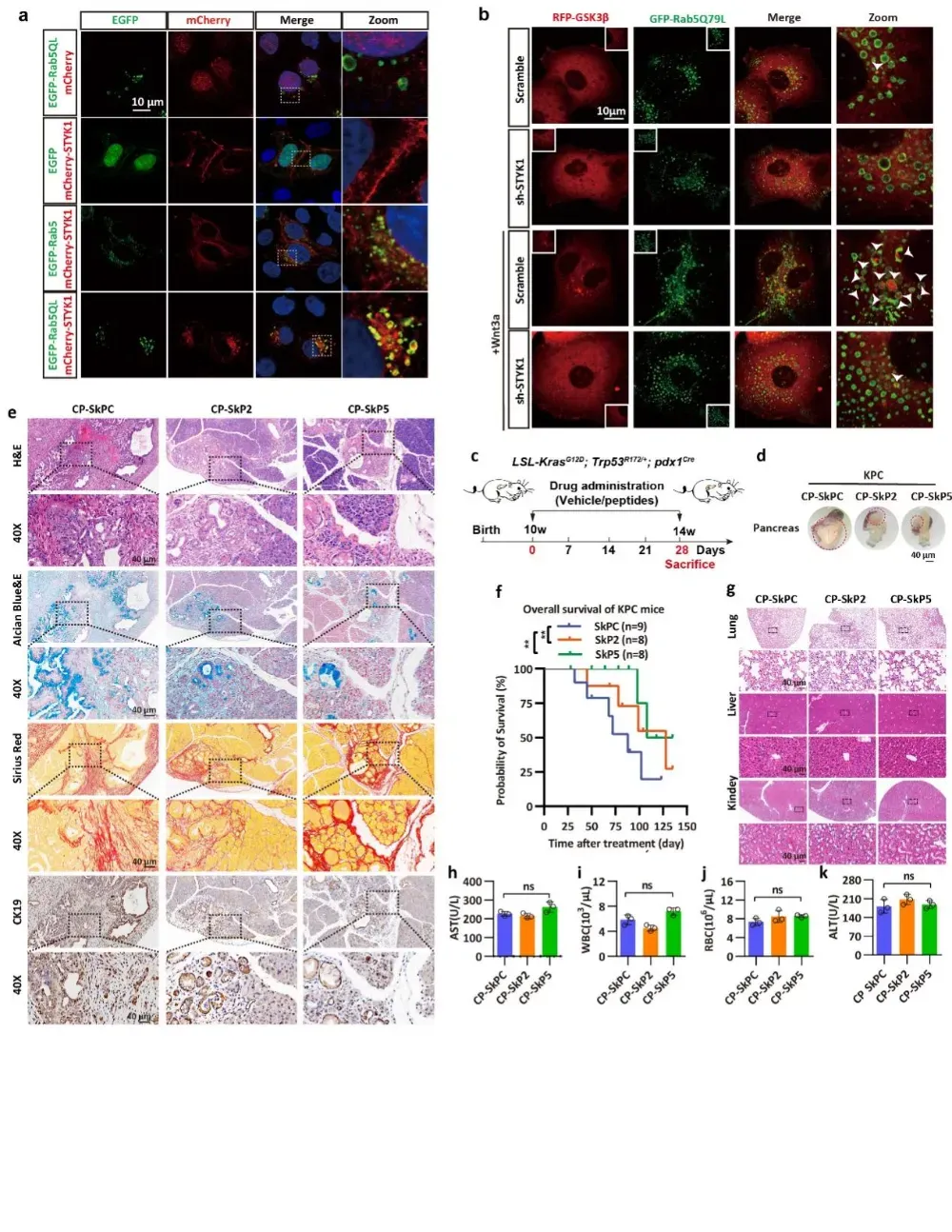
基于上述机制发现,研究团队设计了靶向STYK1作用界面的抑制短肽。这些经特殊修饰的多肽分子在多种动物模型中展现出显著抗肿瘤效果:在自发胰腺癌模型中,治疗组动物生存期获得有效延长,肿瘤组织负荷明显减轻,病理特征显著改善。分子水平检测显示,多肽治疗有效阻断了致癌信号通路的异常激活。也表明该短肽药物未引发明显毒副作用。目前相关药物前体已申报发明专利,表明了针对胰腺癌中Wnt通路调控的短肽类药物在胰腺癌治疗中的转化应用前景。
