基因治疗可以应对多种疾病,比如单基因疾病和癌症。然而,现有的基因药物递送平台存在耐受性差、规模化困难以及免疫原性问题,限制了基因治疗的临床应用。病毒载体(如腺相关病毒,AAV)和非病毒载体(如脂质纳米颗粒,LNPs)是目前常用的基因递送工具,但各有其局限性:AAV受制于免疫原性问题,人体在接触AAV后可能会产生针对AAV的抗体,导致无法重复给药,这限制了长效基因表达或多次治疗的需求;而LNPs则含有可电离的脂质成分,在全身递送时可能会导致肝脏毒性,特别是高剂量时,可能引发肝损伤。如何开发出一种既高效、安全,又适用于重复给药的基因递送平台,是基因治疗领域面临的关键挑战之一。
近日,来自加拿大阿尔伯塔大学的 John D. Lewis和Arun Raturi团队在Cell上发表了题为Safe and effective in vivo delivery of DNA and RNA using proteolipid vehicles的文章,融合病毒和非病毒递送平台的优点,解决了现有基因药物递送的问题。
首先,为了寻找具有高效融合活性的蛋白,研究者筛选了多个融合蛋白(fusion-associated small transmembrane,FAST蛋白)结构域,通过构建不同的嵌合体蛋白并进行细胞融合实验来评估其膜融合活性。筛选结果显示,p14endo15嵌合蛋白在所有构建中表现出最强的融合活性,被选为后续实验中的核心蛋白。
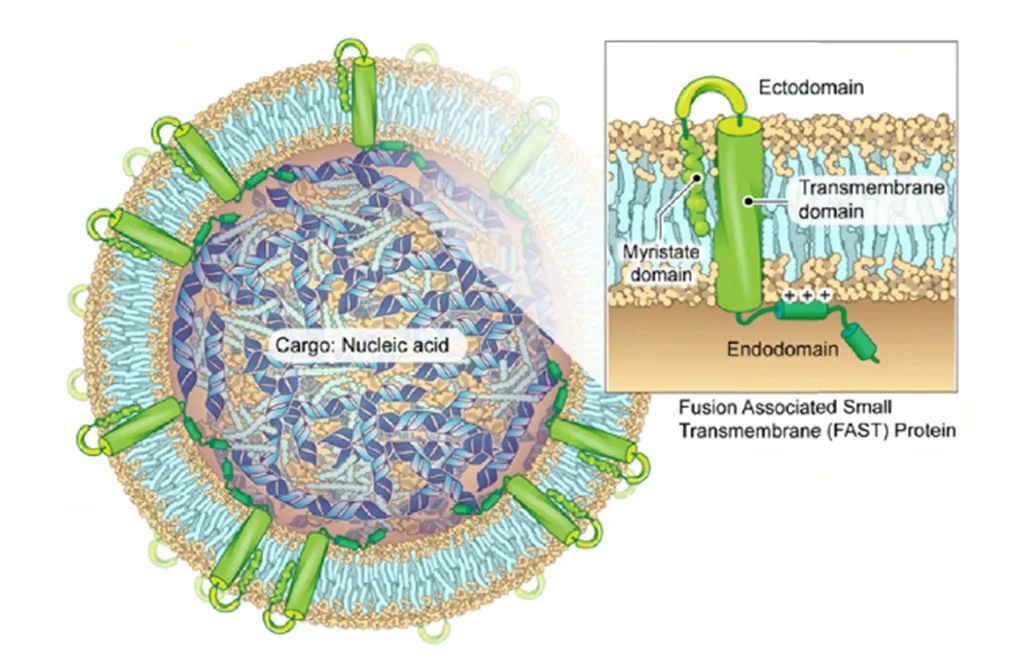
图1:在PLV膜中FAST蛋白的拓扑结构。
为了提高核酸递送效率,他们使用不同的脂质组分(如DODAP、DOTAP等)优化脂质体的组成,并评估其对基因递送的效率和细胞毒性。通过体外实验在细胞中验证pDNA(质粒DNA)和mRNA递送效率,他们筛选出了携带基因表现出最高的基因表达水平,并且具备较低的毒性的脂质配方。
接着,研究人员通过小鼠模型进行体内基因递送实验,分别注射MC3-LNP和FAST-PLV,评估pDNA递送后的组织分布、生物发光(报告基因表达)和免疫反应,验证FAST-PLV在体内递送核酸的安全性和有效性。他们发现,与MC3-LNP相比,FAST-PLV在更高剂量下依然具有较好的耐受性,没有显著的肝毒性。同时,FAST-PLV在多个器官中实现了广泛的基因递送,特别是在肺、脾、脑等组织中的基因表达显著提高。且FAST-PLV即使在多次给药后,依然能够维持基因表达,并且未引发显著的免疫反应。
最后,他们在非人灵长类动物中进行FAST-PLV的系统递送,分析其在多个组织中的pDNA分布,评估不同剂量下的毒性和免疫反应。结果显示FAST-PLV在非人灵长类动物中的多器官(包括肺、脾、骨髓等)表现出广泛的基因表达,且未检测到明显的毒性。
综上所述,文章中的实验从蛋白优化开始,逐步提升递送效率,接着验证其在体外和体内的有效性,并最终通过小鼠和非人灵长类动物的实验,确认安全性和重复给药的潜力,形成了完整的递送平台开发流程。文章展示了一种新型的基因递送平台FAST-PLVs,它融合了病毒和非病毒递送系统的优点,实现了低免疫原性、高耐受性以及广泛的组织表达,有望在基因治疗领域获得更广泛的应用。
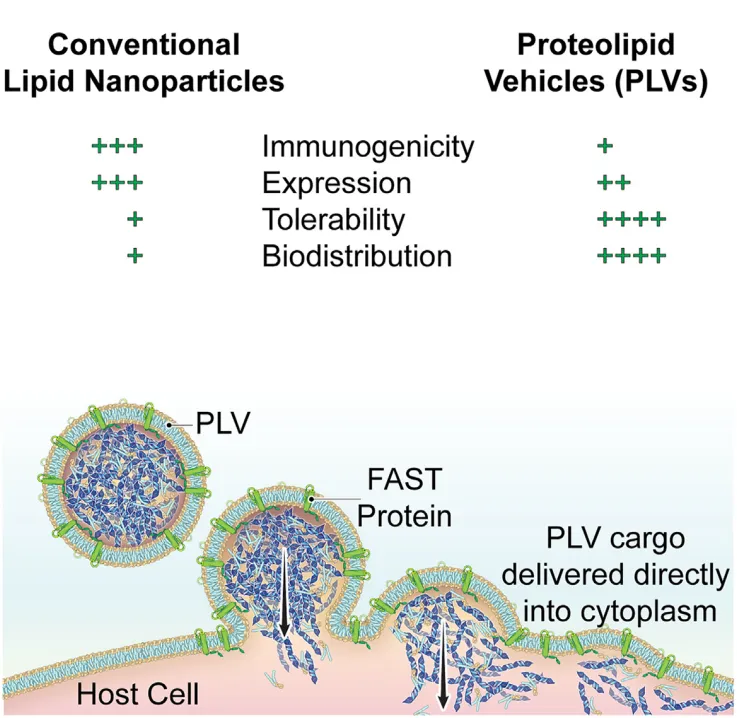
图2:PLV递送平台与传统脂质纳米颗粒的对比。
原文链接:https://doi.org/10.1016/j.cell.2024.07.023
