近日,上海交通大学医学院张良课题组与中国科学院上海药物研究所罗成课题组合作,在化学生物学著名期刊Chemical Science(《化学科学》)上发表了题为“Thymine DNA glycosylase recognizes the geometry alteration of minor grooves induced by 5-formylcytosine and 5-carboxylcytosine”的研究论文。该研究揭示了人类主动去甲基化途径中关键酶胸腺嘧啶DNA糖基化酶TDG对该途径中多个结构高度类似核酸修饰物5mC、5hmC、5fC和5caC的选择性识别和催化分子机制,为进一步深入了解人类唯一发现的DNA主动去甲基化途径的作用机制和生物功能奠定了理论基础。

上海交通大学医学院
张良教授

中国科学院上海药物研究所
罗成研究员
哺乳动物基因组上DNA胞嘧啶的甲基化(5mC)是经典的表观遗传修饰。基因启动子区域的胞嘧啶被高度甲基化可造成基因的沉默,从而实现基因的时空调控,改变生物功能。2011年,人类首个DNA主动去甲基化途径被发现,实现了从5mC到胞嘧啶的转换。然而,由于5mC、5hmC、5fC和5caC这四种核酸修饰物的化学结构高度类似,所以TDG如何选择性识别和催化这些核酸修饰物仍不清楚。
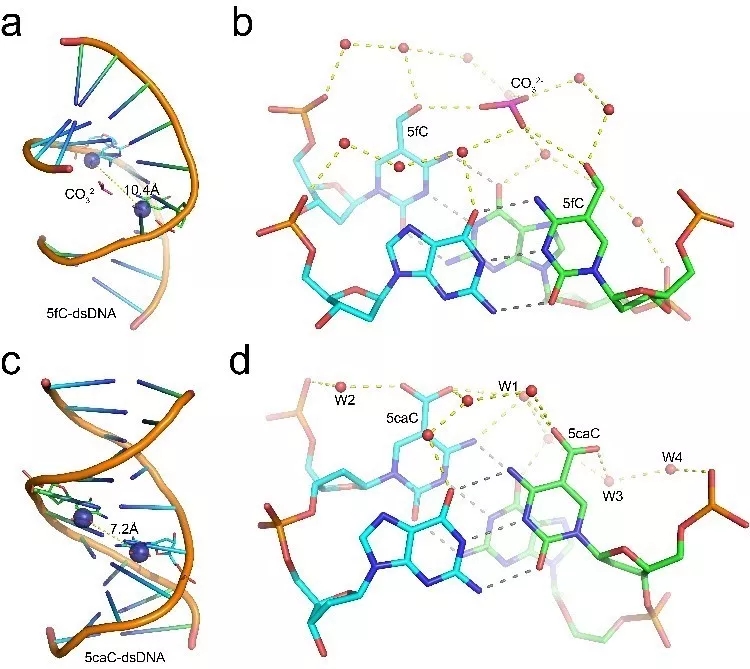
5fC或5caC修饰在DNA双螺旋晶体结构中
不同的分子作用网络
针对这一科学问题,张良课题组分别解析了含有5mC、5hmC、5fC和5caC核酸修饰的短链DNA双螺旋晶体结构;罗成课题组针对晶体结构开展了分子动力学模拟,发现5fC和5caC可以引起DNA双螺旋小沟的显著构象变化。而TDG正好通过位于小沟附近的关键氨基酸R275来感应这种构象变化,从而帮助TDG对不同核酸修饰物进行选择性识别和催化。这部分研究回答了哺乳动物DNA去甲基化途径中对多种高度类似核酸修饰物的选择性识别和催化的科学问题,为进一步研究该途径的生物功能奠定了理论基础。
上海交通大学基础医学院硕士生付天然、中科院上海药物研究所博士生刘丽萍和中科院上海生化细胞所博士生杨清林为该论文的共同第一作者。上海交通大学医学院张良研究员和中科院上海药物所罗成研究员为该论文的共同通讯作者。该工作得到了国家自然科学基金委“生物大分子动态修饰与化学干预”重大研究计划、美国NIH项目和上海市转化医学协同创新中心的资助,并得到上海光源BL17U1/19U1和国家蛋白质中心平台的大力支持。
供稿部门:罗成课题组
供稿人:罗成
