本文由李祥供稿,文章转载于BioAr
蛋白质翻译后修饰在生命体中具有十分重要的作用。它不仅使蛋白质的结构更为复杂, 功能更为完善, 调节更为精细,而且在众多生命进程中发挥着关键作用,如信号转导、新陈代谢、增殖分化、表观遗传等【1】。这种修饰过程受到一系列修饰酶(writer,书写器)和去修饰酶(eraser,擦除器)的严格调控,其功能的发挥亦依赖于相应效应蛋白(reader,阅读器)对修饰位点的特异性识别。越来越多证据表明,蛋白质翻译后修饰调控和识别的紊乱是一些人类疾病(如癌症)的重要发病原因之一【2-4】,这也使得蛋白质修饰的结合蛋白成为近年来药物研发的热门靶点之一【5,6】。
蛋白质翻译后修饰所介导的蛋白质相互作用常常是高度动态的,且具有结合力微弱和瞬时性等特性,因此,传统的用于研究蛋白质相互作用的方法(如酵母双杂交系统、免疫共沉淀、荧光共振能量转移)具有很大的局限性。为克服上述困难,基于光交联的化学生物学方法应运而生,此方法可在特定激发条件下将非共价的相互作用转化为不可逆的共价相互连接从而实现对蛋白质翻译后修饰介导的蛋白质相互作用的捕捉【7-9】。光交联具有高度邻近依赖的特性,除了用于发现相互作用蛋白,亦可用于研究蛋白质相互作用区域。然而,由于光交联复合物的富集及分析存在着很大的困难,使其在这方面的运用仍然面临巨大的挑战(图1A)。
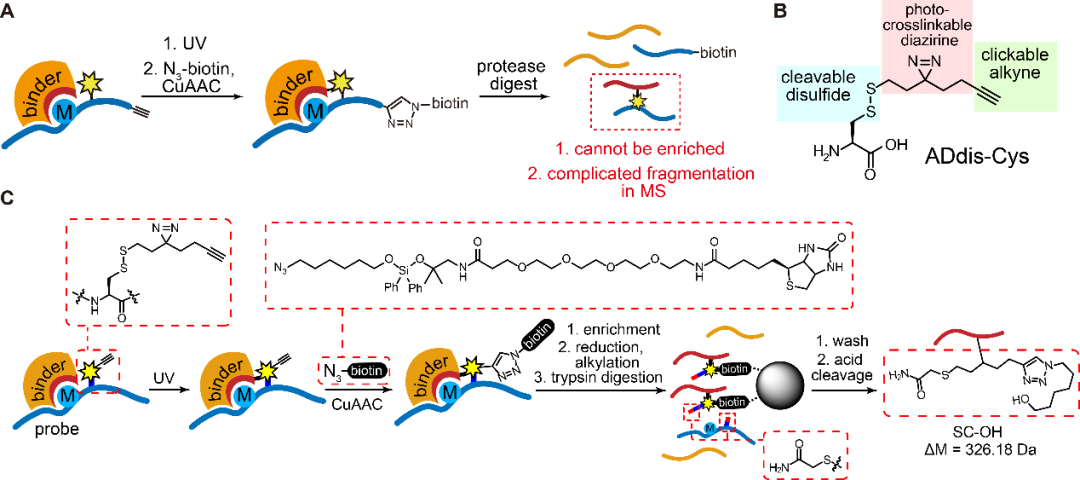
图1:A)传统光交联方法存在富集及分析交联多肽的难点;B)三重功能氨基酸ADdis-Cys的化学结构;C) 运用ADdis-Cys-MS对交联的多肽进行富集以及分析。
2021年4月23日,香港大学化学系李祥课题组在Molecular Cell杂志发表题为“A tri-functional amino acid enables mapping of binding sites for posttranslational modification-mediated protein-protein interactions”的研究论文。在该研究中,作者开发了一种新型三重功能氨基酸ADdis-Cys(图1B)。首先,此氨基酸在修饰位点临近区域的定点引入可以捕捉蛋白质修饰介导的动态的蛋白质相互作用;其次,该氨基酸具有的光交联、装载富集标签、可双向洗脱的特点,亦可将捕获的交联肽段直接用于质谱分析,并在很大程度上简化了分析流程,提高了质谱分析的便捷度(图1C)。

作者首先设计并合成了基于H4K4me3的多肽探针,并在第七位引入ADdis-cys,从而在单蛋白水平成功实现了对已知的H3K4me3阅读器(如SPIN1、ING2和MORC3)的特异性捕获。通过结合SILAC质谱分析技术,作者在全细胞蛋白水平亦检测到16个已知的H3K4me3识别蛋白,包括12个组蛋白甲基化阅读器和4个组蛋白甲基化擦除器。此外,ADdis-cys应用于H3K4cr的多肽探针也成功的捕获了巴豆酰化擦除器-SIRT3。
以此为基础,作者运用此新型探针,开发了解析“阅读器”与其特定蛋白质修饰底物的相互作用区域的方法。首先在单蛋白层面,作者运用不同探针进行ADdis-Cys-MS分析,鉴定带有SC-OH标记的多肽序列是否分布于结合蛋白(阅读器和擦除器)特异性识别相应蛋白质修饰的口袋内。该技术在研究组蛋白H3修饰介导的SPIN1-H3K4me3(图2A)和SIRT3-H3K4cr相互作用、组蛋白H4修饰介导的L3MBTL1-H4K20me2(图2B)相互作用以及非组蛋白修饰介导的L3MBTL1-p53K382me1(图2C)UHRF1-LIG1K126me3相互作用中均得到了验证。除此之外,作者应用此新型探针亦实现了对结构信息缺失或不足的蛋白质修饰介导的蛋白质相互作用的解析以及信息的补充,包括ZMYND8-H3K4me0/1K14ac(图2D)和WDR5-H3K4me3相互作用。
最后,作者成功的将该技术应用于从复杂蛋白样品中钓取蛋白质翻译后修饰识别蛋白的同时,通过ADdis-cys-MS分析直接从中获取有关结合区域的信息。利用上述合成的H3K4me3探针,作者从HeLa S3细胞裂解液当中鉴别出了SPIN1、PYGO2、WDR5分别与H3K4me3相互作用的结合区域。同时,作者发现该探针可被用与获取相关无序蛋白结构域(intrinsically disordered domains)的结构信息。由此,作者分析了NPM1中3段无序结构域(A1、A2、A3 tracts)中A1与组蛋白的相互作用(图3A)。通过对被钓取的肽段的分析以及多种生物/细胞生物学方法的检测,作者还发现了C1QBP作为的H3-H4组蛋白伴侣,参与核小体组装过程(图3B-C)。
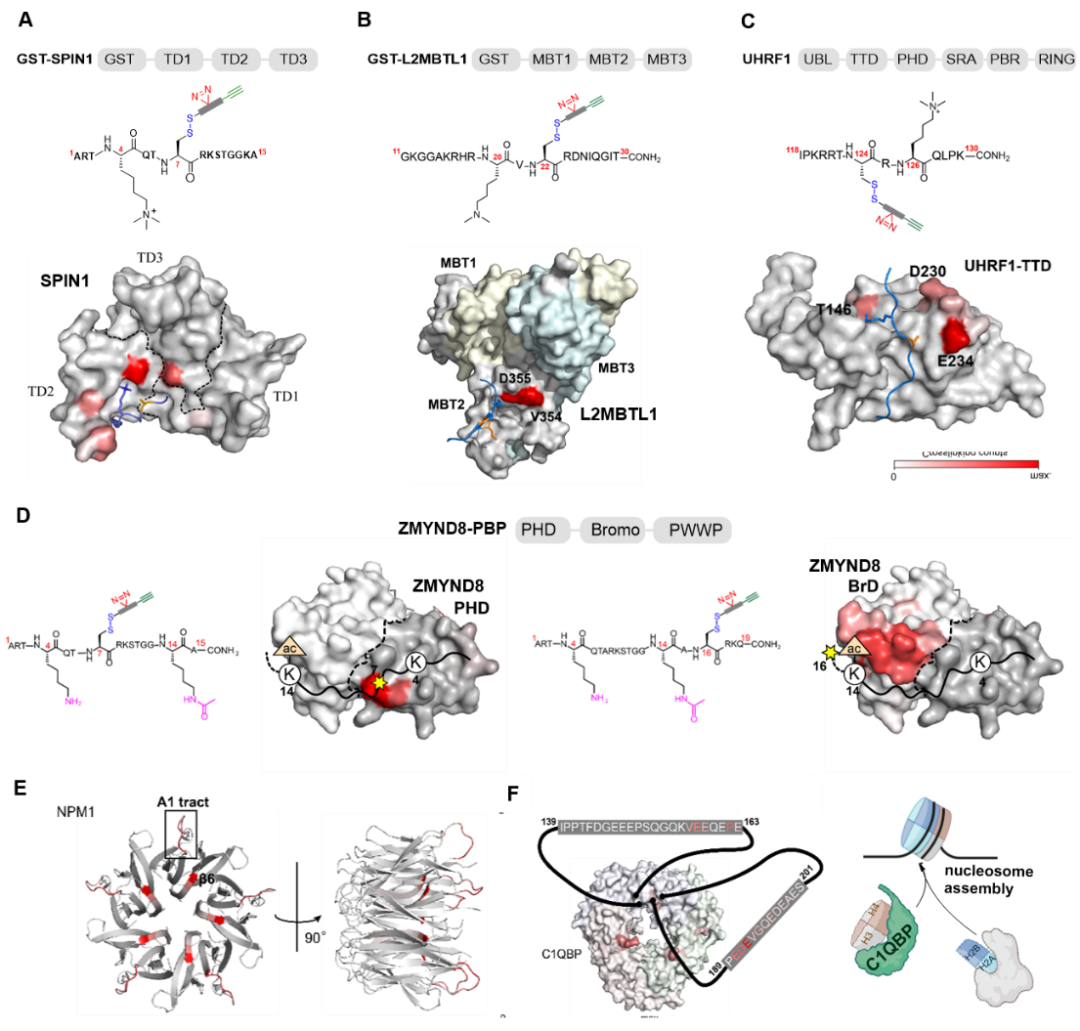
图2:A-D)通过ADdis-Cys-MS分析发现交联多肽序列以及氨基酸残基在结合蛋白特异性识别相应蛋白质修饰的功能基团内的分布。E-F)探针可被用来获取有关无序蛋白结构域(intrinsically disordered domains)的结构信息。C1QBP作为H3-H4组蛋白伴侣,参与核小体组装过程。
此项研究中构建的ADdis-Cys多功能氨基酸在一定程度上突破了传统方法的瓶颈,不仅可以直接解析结合蛋白上用于识别特定修饰的功能结构域,而且大大提高了质谱分析的便捷度。该多功能氨基酸应用于多种不同化学修饰的蛋白结合以及相互作用区域的鉴定,证明了该方法的可行性和普适性。该方法不仅在单蛋白水平,甚至在全细胞蛋白水平都可以定位特定修饰识别蛋白的功能域。此外,该研究还成功的实现了对位于无序结构区域中的功能结构域的“可视化”和新型蛋白质相互作用的识别与鉴定。此方法不仅适用于研究蛋白质修饰介导的蛋白质相互作用,在其他生物大分子修饰领域,例如DNA修饰引起的DNA-蛋白质相互作用,也具有重要参考价值和推广潜力。
香港大学化学系李祥教授及其课题组的博士后研究员鲍秀丛为该文章的共同通讯作者。李祥课题组的博士后研究员林剑威为该文章的第一作者。
原文链接:
https://doi.org/10.1016/j.molcel.2021.04.001
参考文献:
1.Lin, H.; Caroll, K. S., Introduction: Posttranslational Protein Modification. Chemical reviews 2018, 118 (3), 887-888.
2.Rodriguez-Paredes, M.; Lyko, F., The importance of non-histone protein methylation in cancer therapy. Nature reviews. Molecular cell biology 2019, 20 (10), 569-570.
3.Zhao, Z.; Shilatifard, A., Epigenetic modifications of histones in cancer. Genome biology 2019, 20 (1), 245.
4.Chen, L.; Liu, S.; Tao, Y., Regulating tumor suppressor genes: post-translational modifications. Signal Transduct Target Ther 2020, 5 (1), 90.
5.Helin, K.; Dhanak, D., Chromatin proteins and modifications as drug targets. Nature 2013, 502 (7472), 480-8.
6.Kelly, T. K.; De Carvalho, D. D.; Jones, P. A., Epigenetic modifications as therapeutic targets. Nature biotechnology 2010, 28 (10), 1069-78.
7.Dubinsky, L.; Krom, B. P.; Meijler, M. M., Diazirine based photoaffinity labeling. Bioorg Med Chem 2012, 20 (2), 554-70.
8.Preston, G. W.; Wilson, A. J., Photo-induced covalent cross-linking for the analysis of biomolecular interactions. Chem Soc Rev 2013, 42 (8), 3289-301.
9.Li, X.; Foley, E. A.; Molloy, K. R.; Li, Y.; Chait, B. T.; Kapoor, T. M., Quantitative chemical proteomics approach to identify post-translational modification-mediated protein-protein interactions. Journal of the American Chemical Society 2012, 134 (4), 1982-5.
