CRISPR/Cas基因编辑技术由于其简便性和高效性,已经被广泛应用于生物学、医学、农学等领域的基础与应用研究。目前广泛使用的Cas9与Cas12a核酸酶均具有较大的分子尺寸(通常大于1000个氨基酸),而广泛应用于基因治疗中的腺相关病毒(AAV)载体的承载容量却十分有限,在容纳CRISPR核酸酶与引导RNA的编码序列之余往往难以承载更多其他功能元件,这严重限制了其在基因治疗等领域的应用。因此,亟需发掘与鉴定具有更小分子尺寸的CRISPR核酸酶以解决这一技术难题。

2021年9月2日,上海科技大学季泉江团队在Nature Chemical Biology杂志发表了题为Programmed genome editing by a miniature CRISPR-Cas12f nuclease的研究论文。文章系统性表征了一种极小型CRISPR核酸酶—AsCas12f1(仅422个氨基酸)的DNA识别和切割机制,并探究了它作为一种新型基因编辑工具的可能性,成功在细菌和哺乳动物细胞中实现了高效的基因编辑。此研究又一次拓展了CRISPR核酸酶工具库,为开发微型精准基因编辑、表观遗传修饰和治疗工具提供了新的思路。
研究人员首先通过高通量PAM depletion试验鉴定发现AsCas12f1核酸酶可特异性识别的最优PAM序列为5’-TTR(R代表A或G)。而当5’-TTY序列作为PAM时,其-4位的碱基类型将会影响靶向干扰质粒转化的活性(图1)。而后研究者通过Small RNA-seq揭示了AsCas12f1发挥功能所必须的RNA元件为tracrRNA和crRNA组成的二元复合体(图1)。而tracrRNA和crRNA可进一步融合为单一的sgRNA,同时能显著提升双链DNA切割活性(图1)。AsCas12f1能在靶向链的spacer序列下游3 bp处引入一个切口,同时还能在非靶向链上PAM序列下游12 bp处和spacer下游约5 bp处分别引入两个切口,最终产生带有不对称粘性末端的双链DNA断裂(图1)。同时,AsCas12f1还能不依赖PAM序列靶向切割单链DNA。并且靶向切割能激活其附加切割活性,非特异性降解其他单链DNA。
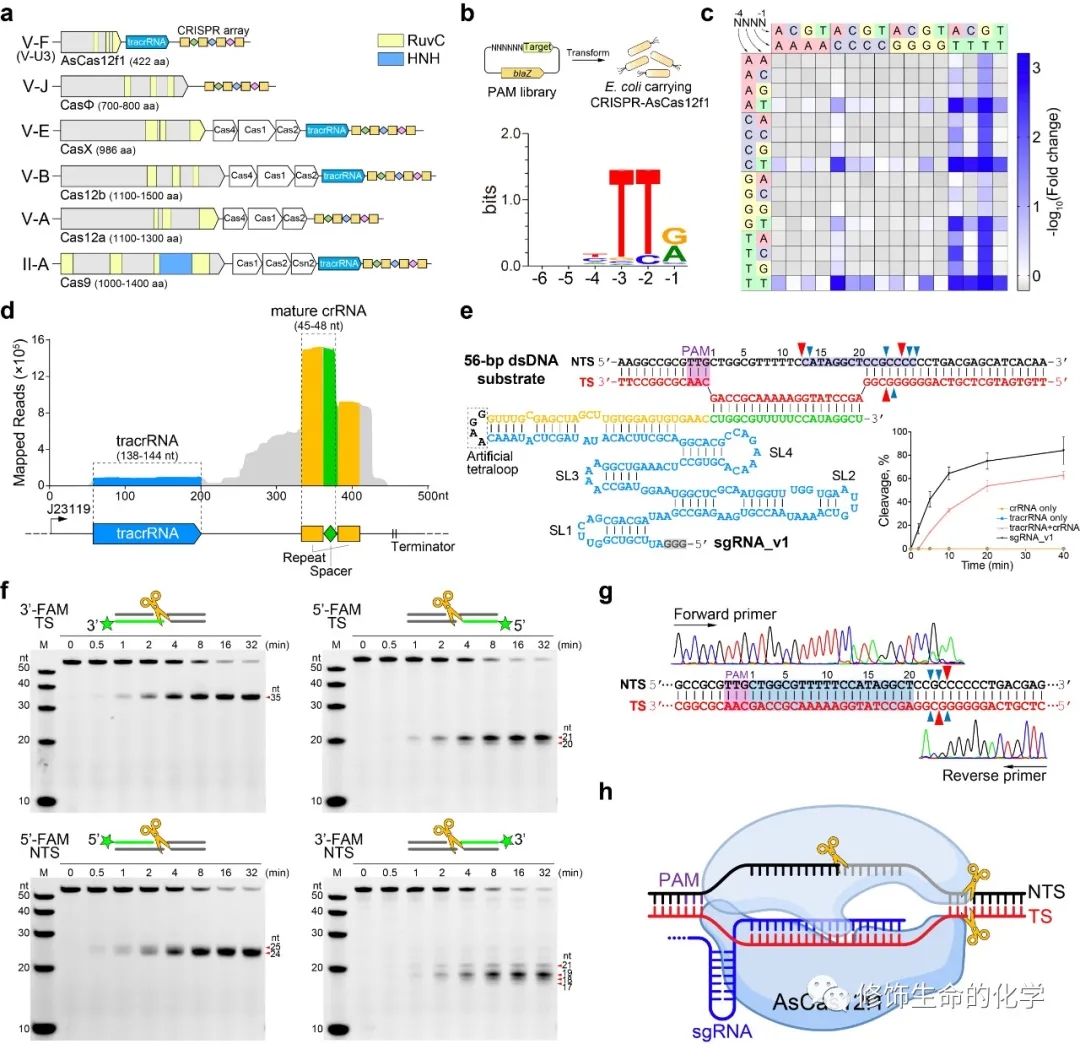
图1 AsCas12f1核酸酶的生化表征
为探究AsCas12f1在基因编辑中的应用潜能,研究人员首先分别向大肠杆菌和肺炎克雷伯氏菌中引入AsCas12f1,以及用于增强细菌内同源重组活性的Lambda Red重组酶系统和单链DNA修复模板。这一方法实现了在这两种细菌中的高效精确基因删除和点突变。而后研究人员又将AsCas12f1分别通过质粒、核糖核蛋白复合体(RNP)以及腺相关病毒(AAV)等方式导入哺乳动物细胞中,并成功在靶位点引入了缺失或插入突变(Indel)(图2)。
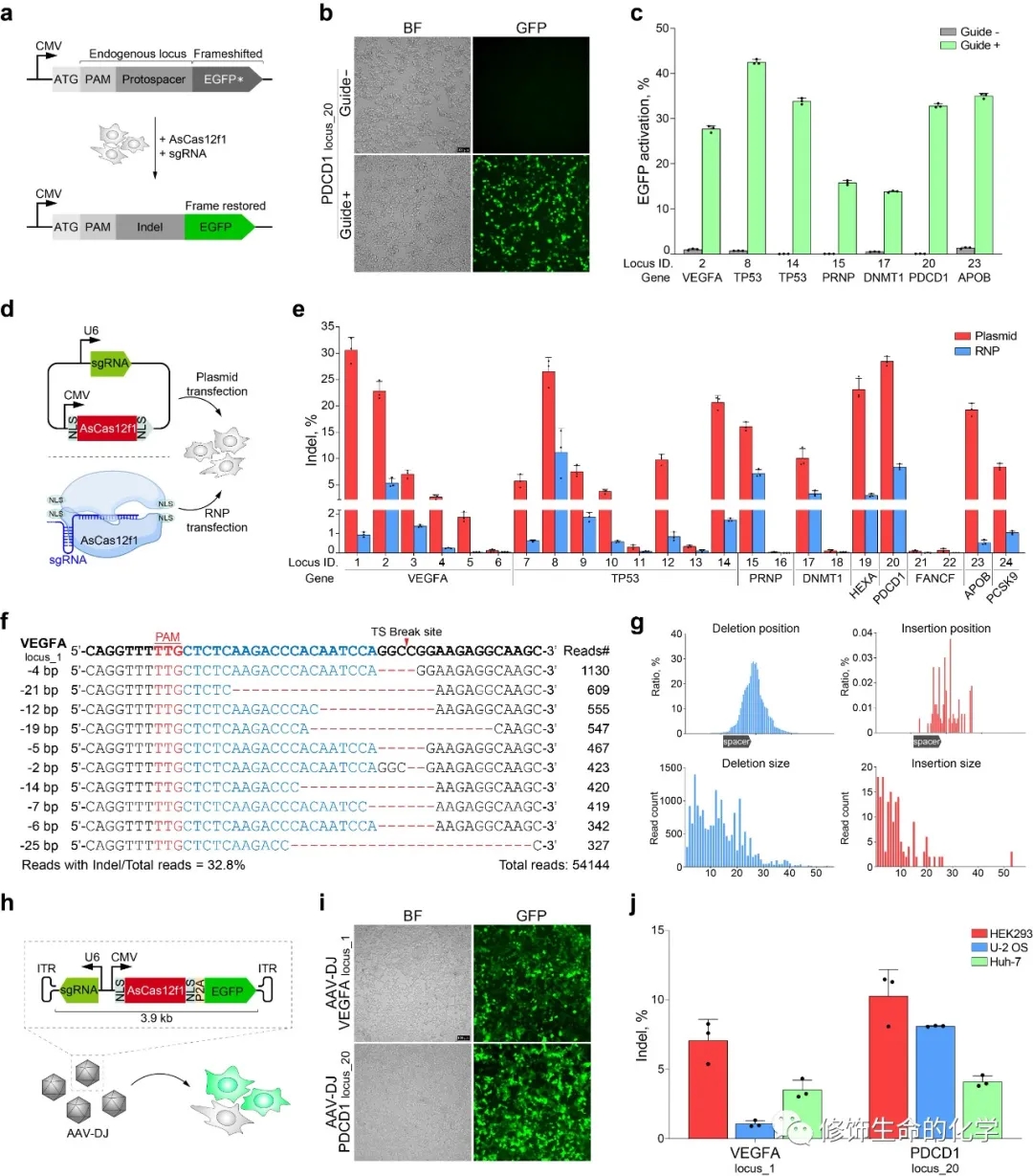
图2 AsCas12f1核酸酶在哺乳动物细胞中具有基因编辑能力
AsCas12f1是目前已知分子尺寸最小(仅422个氨基酸)的且在哺乳动物细胞中具有基因编辑能力的CRISPR核酸酶。它的发现与鉴定为分子生物学、生物医学研究和临床治疗提供了新的工具。而基于AsCas12f1或同家族的其他极小型CRISPR核酸酶或能开发出更多可实现单AAV包装的复合型CRISPR基因操作工具。
