细胞精确的自我复制是其生活史的重要组成部分,也是人体健康的重要保证。在有丝分裂过程中,包含在染色体中的父代遗传信息在经历诸多复杂的运动后,均等地传递给两个子细胞。染色体分离的时空序列性及保真性通过着丝粒与纺锤体的协调来完成(Cleveland et al., 2003;Liu et al., 2020)。着丝粒组装与结构变异可导致染色体碎片化及基因组不稳定表型(Ly and Cleveland, 2017),促进肿瘤的发生与发展。PLK1是有丝分裂重要的调控激酶之一,负责有丝分裂进入、中心体成熟、纺锤体可塑性、染色体排列和胞质分裂等多种有丝分裂事件。但是PLK1激酶活性在有丝分裂前中期调控的详尽分子机制仍不清楚。
2021年7月13日在Cell Reports杂志在线发表“Feedback control of PLK1 by Apolo1 ensures accurate chromosome segregation”,细胞动力学教育部重点实验室发掘新着丝粒蛋白Apolo1并揭示细胞更新质量控制机制。针对PLK1激酶在有丝分裂前中期的时空动态特征及其关联的生物学意义,中国科学技术大学姚雪彪/刘行/刘丹合作团队采用真核细胞有丝分裂调控网络基因共进化策略与细胞器时空蛋白质组学方法(Wang et al., 2004; Liu et al., 2020),发现并命名了一个新颖的着丝粒功能蛋白,Apolo1(Adaptor of Polo1)。Apolo1在后生代细胞进化中呈现,并在动物中显示出高保守性。这项工作系统地解析了Apolo1的生物化学功能,揭示Apolo1如何通过动态连接着丝粒蛋白激酶PLK1与磷酸酶PP1γ的互作(图一),为详尽的构-效研究奠定基础。
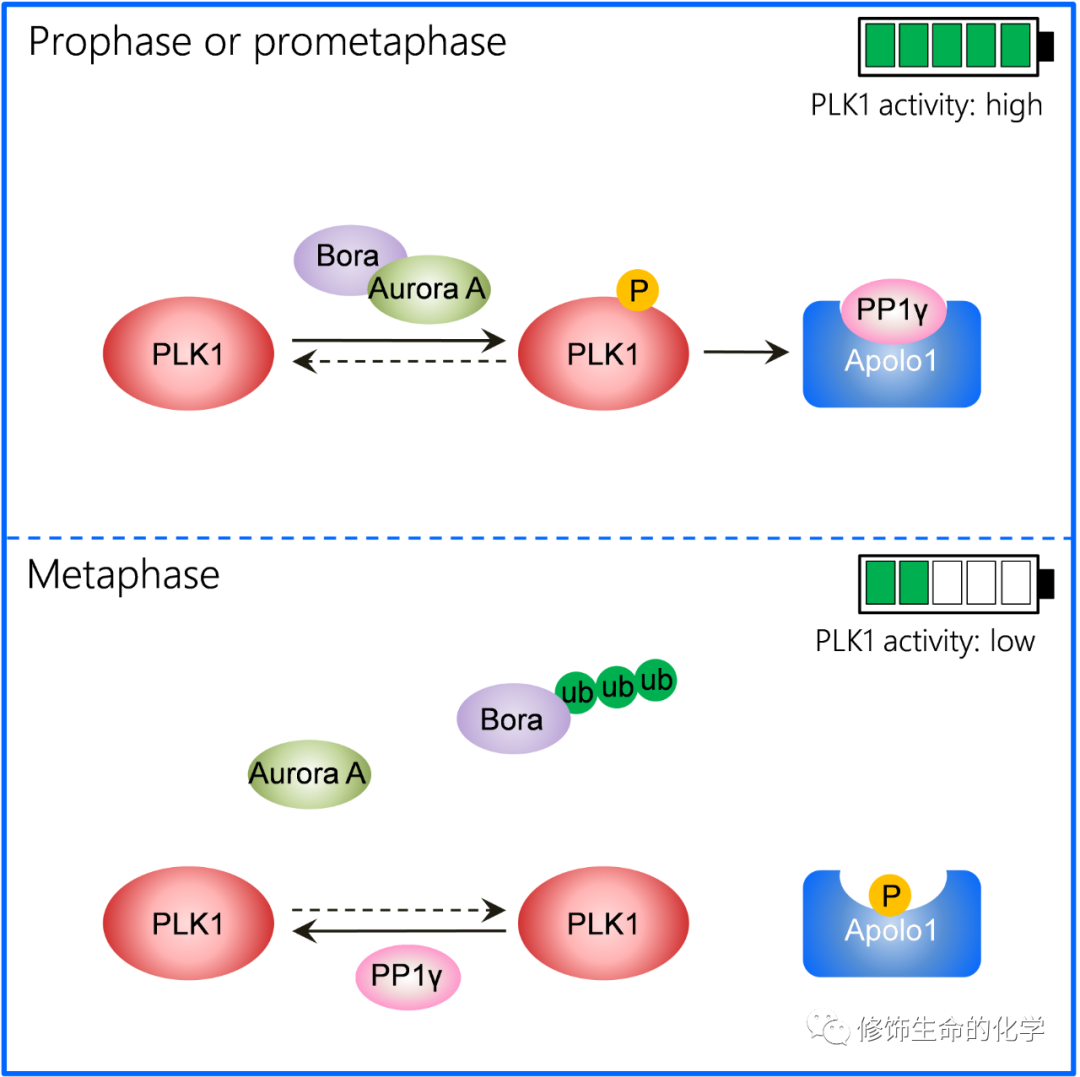
从分子机制上来说,Apolo1通过其N端与PLK1的PBD结构域相互作用,而其C端包含一个经典的PP1γ磷酸酶结合基序。有趣的是,Apolo1的PP1γ结合活性受到PLK1激酶磷酸化的调控。为此,PLK1-Apolo1-PP1γ构筑了一个新的功能反馈环,在有丝分裂前中期精准地调控着丝粒可塑性与有丝分裂染色体动力学,保证基因组稳定性。事实上,功能蛋白质组学与模式生物学研究提示了Apolo1在基因组稳定性维系与干细胞增殖过程中的重要功能(Li et al., 2018; Olivieri et al., 2020)。
据悉,中国科学技术大学博士后徐雷雷、博士生Ali Mahboob和博士后段文秀为本论文的共同第一作者,中国科学技术大学姚雪彪教授、刘行教授、刘丹教授、窦震副教授和袁枭副研究员为该文的共同通讯作者。研究过程中,德国马普细胞发育所的Anthony Hyman团队、中国科学院上海营养健康所李林团队、潘巍峻团队与南方科大田瑞军团队给予了协作与支持。这项工作于2021年7月13日在Cell Reports杂志在线发表“Feedback control of PLK1 by Apolo1 ensures accurate chromosome segregation” (图二;doi: 10.1016/j.celrep.2021.109343)。

原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)00719-1
参考文献
1. Cleveland, DW, Mao, Y, and Sullivan, KF. (2003). Centromeres and kinetochores: from epigenetics to mitotic checkpoint signaling. Cell 112, 407-421.
2. Li, D., Xue, W., Li, M., Dong, M., Wang, J., Wang, X., Li, X., Chen, K., Zhang, W., Wu, S., et al. (2018). VCAM-1(+) macrophages guide the homing of HSPCs to a vascular niche. Nature 564, 119-124.
3. Liu, X., Liu, X., Wang, H., Dou, Z., Ruan, K., Hill, D.L., Li, L., Shi, Y., and Yao, X. (2020). Phase separation drives decision making in cell division. J Biol Chem 295, 13419-13431.
4. Ly, P., and Cleveland, D.W. (2017). Rebuilding chromosomes after catastrophe: emerging mechanisms of chromothripsis. Trends Cell Biol 27, 917-930.
5. Olivieri, M., Cho, T., Alvarez-Quilon, A., Li, K., Schellenberg, M.J., Zimmermann, M., Hustedt, N., Rossi, S.E., Adam, S., Melo, H., et al. (2020). A genetic map of the response to DNA damage in human cells. Cell 182, 481-496 e421.
Wang, H., Hu, X., Ding, X., Dou, Z., Yang, Z., Shaw, A.W., Teng, M., Cleveland, D.W., Goldberg, M.L., Niu, L., et al. (2004). Human Zwint-1 specifies localization of Zeste White 10 to kinetochores and is essential for mitotic checkpoint signaling. J Biol Chem 279, 54590-54598.
