金属离子在生命活动中扮演着广泛而重要的角色,可以作为酶的活性中心(金属中心)、细胞信号转导的关键分子等,参与遗传信息传递、细胞能量代谢、氧气输运、神经信号传送等很多生命过程。另一方面,过量的金属离子会引起生物体的损伤,造成多种疾病。为了保持体内金属离子处于合适的范围,生物体需要对细胞内的金属离子水平进行精准的调控。在这一过程中,金属调控蛋白(Metalloregulatory Protein)发挥着决定性的作用。它们将金属离子的特异识别与基因转录偶联在一起,实现细胞内金属离子浓度的动态调控。对这类蛋白质工作原理的研究,有助于理解细胞内金属离子动态平衡的维持机制。
“别构调节”(Allosteric Regulation)是金属调控蛋白发挥功能的重要特征,它们通常能将蛋白质在金属离子结合区域产生的构象变化有效地传递到DNA结合区域,进而改变与基因序列的结合能力,实现对下游离子通道、离子泵等蛋白的转录调控。目前已知的“别构调节”机制可以通过金属离子的价态变化、配位氨基酸的改变以及金属中心周围的小分子配体变化等途径完成,但不论是哪一种方式,参与配位的氨基酸所使用的配位基团通常是固定不变的。
近日,北京大学化学与分子工程学院陈鹏课题组在《美国国家科学院院刊》(Proc. Natl. Acad. Sci. U. S. A.)上发表题为“ Allosteric histidine switch for regulation of intracellular zinc(II) fluctuation”的论文 (doi: 10.1073/pnas.1708563115) ,报道了一种金属蛋白“别构调节”的新机制。通过对锌离子调控蛋白-ZitR的结构与功能解析,他们发现ZitR能够“切换”同一个组氨酸咪唑环上的不同氮原子与锌离子进行配位,从而动态调控这一转录因子的构象变化,实现对细胞内锌离子水平的感知与调控。他们将这种蛋白质别构动态调控的新机制命名为“组氨酸切换”(Histidine Switch)。

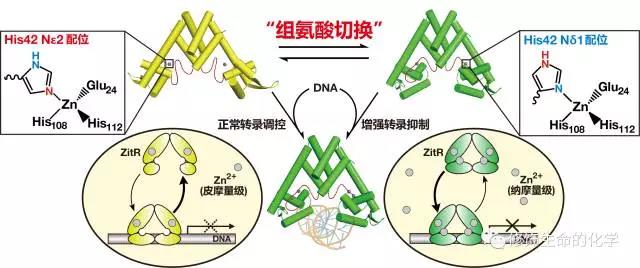
“组氨酸切换”介导的金属蛋白动态调控
陈鹏课题组发现在ZitR蛋白的两个锌离子结合位点中,第一位点内的一个组氨酸His42的配位原子会直接影响蛋白的构象变化。ZitR巧妙地利用这一关键组氨酸感知细胞内锌离子的浓度变化,并动态“切换”其咪唑环上与锌离子配位的氮原子:当体内锌离子浓度处于正常水平时(皮摩量级),His42使用其咪唑环上的ε-氮原子(Nε2)与锌离子配位,实现正常的转录调控,保持体内锌离子浓度平衡;而当细菌受到高浓度锌离子刺激时(胞内浓度纳摩量级), His42会改用咪唑环上的δ-氮原子(Nδ1)与锌离子配位,这一切换导致的ZitR构象变化能够增强其与DNA的结合能力,对下游锌离子泵等基因的转录产生更为强烈的抑制,是生命体对高浓度锌离子刺激做出的一种响应。
陈鹏课题组长期致力于包括金属蛋白在内的蛋白质动态调控机制研究,此前的一项工作发现细菌多重抗药性转录因子MarR是一种铜离子调控蛋白,揭示了铜离子介导的细菌抗药新机制(Nat. Chem. Biol., 2014,10,21–28.)。这一成果及他们课题组在活细胞内从事金属钯催化的生物正交反应等工作,获得了2017年国际生物无机化学会早期职业奖(SBIC Early Career Award)。这次发现的“组氨酸切换”,是金属蛋白动态调控的又一全新机制,很可能还适用于一些分子机制未被解明的金属调控蛋白,加深了我们对生物体内金属离子动态平衡调控的认识。
北大-清华生命科学联合中心博士研究生祝融峰、化学与分子工程学院博士毕业生宋艳群和博士后刘海萍(现于中国科学院天津工业生物技术研究所担任副研究员)是该论文的共同第一作者。相关工作得到了国家自然科学基金委、科技部、教育部、北大-清华生命科学联合中心等的资助。
